T-Zell-Aktivierung
Forschungsbericht (importiert) 2009 - Max-Planck-Institut für Immunbiologie und Epigenetik
Einleitung
Das Immunsystem ist eines der größten Organe im menschlichen Körper. Es ist dafür verantwortlich, Eindringlinge wie Bakterien oder Viren, aber auch Krebszellen, zu bekämpfen. Nachdem das Immunsystem diese krankheitserregenden Mikroben oder Tumorzellen erkannt hat, werden sie zerstört. Das geht normalerweise auf eine komplexe Art vor sich, bei der nicht-infiziertes, gesundes Gewebe von der Immunreaktion verschont werden soll. In der Tat muss das Immunsystem die schwierige Aufgabe bewältigen, die fremden von den körpereigenen Zellen zu unterscheiden. Fremde Zellen sollen angegriffen und vernichtet werden, während die körpereigenen Zellen nicht gefährdet werden dürfen. Der Hauptzelltyp, der in diesen Prozess involviert ist, ist die T-Zelle.
T-Zellen exprimieren den T-Zell-Antigen-Rezeptor (TCR-CD3)-Komplex [1]. Dieser Rezeptor bindet fremde Antigene mit hoher Affinität, was zur Aktivierung der Zellen und der Einleitung einer Immunantwort führt, und Selbstantigene mit niedriger Affinität, was nicht zur Aktivierung der T-Zelle führt.
Der TCR-CD3 ist ein Transmembran-Multi-Proteinkomplex, der am Anfang eines intrazellulären Signal-Netzwerks steht. Dieses Netzwerk beruht auf verschiedenen Ebenen streng kontrollierter Signalmoleküle, die ein komplexes und dynamisches Verhalten zeigen. Defekte in diesem Netzwerk können unangemessene Immunreaktionen und schwere Funktionsstörungen wie Typ 1-Diabetes oder Multiple Sklerose hervorrufen.
Wichtige offene Fragen sind: Wie funktioniert der TCR-CD3-Komplex oder mit anderen Worten: Wie wird die Information von außerhalb der Zelle ins Zellinnere weitergegeben? Wie können Fremdstoffe von köpereigenen Stoffen unterschieden werden? Welches Verhalten zeigt das intrazelluläre Signaltransduktions-Netzwerk, das die Immunantwort steuert?
In der Vergangenheit konnte die Gruppe um Wolfgang Schamel zwei wichtige Beiträge zum Verständnis des molekularen Mechanismus der TCR-CD3-Aktivierung beisteuern. Erstens wurde gezeigt, dass der TCR-CD3-Komplex in verschiedenen aggregierten Formen vorliegt [1; 2]: als monovalenter Komplex, der nur ein Antigen binden kann, und als multivalenter Komplex, der mehrere Antigene binden kann. Zweitens, wurde eine Konformationsänderung des TCR-CD3s gefunden, die nach Antigenbindung ausgelöst wird [3; 4].
Konformationsänderung des TCR-CD3s
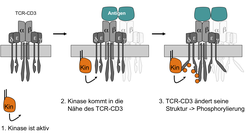
Die Wissenschaftler am MPI für Immunbiologie konnten zeigen, dass die Antigen-induzierte Konformationsänderung des TCRs essentiell für die Aktivierung der Zelle ist [3; 5]. Die zytoplasmatischen Teile des TCRs werden freigelegt, sodass Kinasen den Rezeptor phosphorylieren und Adaptorproteine rekrutieren können (Abb. 1). Zusätzlich wurde der molekulare Mechanismus, mit dem Antigenbindung die Konformationsänderung auslöst, aufgeklärt. Damit wurde zum ersten Mal ein schlüssiges Modell entwickelt, das in kausalen Schritten von der Antigenbindung bis zur Phosphorylierung reicht.
Weiterhin wurde gezeigt, dass viele, jedoch nicht alle Liganden für die γδTCR-CD3 diese strukturelle Änderung auslösen. Im Gegensatz dazu haben alle untersuchten Liganden für die αβTCR-CD3 die Änderung ausgelöst. Das liegt wahrscheinlich an dem großen und heterogenen Spektrum an verschiedenen Liganden für den γδTCR-CD3, während der αβTCR-CD3 nur einen Liganden – nämlich Peptid-MHC – besitzt.
Regulation der Sensitivität einer Immunantwort
Um naive T-Zellen, die noch nie stimuliert worden sind, zu aktivieren, braucht man einen stärkeren Stimulus als für Gedächtnis-T-Zellen. Letztere erlauben eine schnellere zweite Immunantwort und werden auch immunologisches „Gedächtnis“ genannt. Dieses Gedächtnis ist wichtig für Impfungen. Wie diese wichtige Regulation der Immunantwort bewerkstelligt wird, ist nicht vollständig aufgeklärt.
Die Schamel-Gruppe konnte zeigen, dass naive T-Zellen weniger multivalente TCR-CD3 besitzen als Gedächtnis-T-Zellen. Es wird vermutet, dass das Verhältnis von mono- zu multivalenten TCR-CD3 die Bindungskraft zu dem Antigen und damit die Sensitivität der T-Zellaktivierung reguliert. Damit ist man einem neuen grundlegenden Mechanismus auf der Spur, der Signaltransduktionsereignisse reguliert. Diese Regulation soll nun auf biochemischer und immunologischer Ebene eingehender untersucht werden.
Rolle der Lipide in der Funktion des TCR-CD3s
Transmembran (TM)-Regionen sind häufig stark konserviert. Schamel vermutet, dass jede TM-Region bestimmten Lipiden gegenüber eine andere Affinität aufzeigt. Somit versammelt jedes TM-Protein andere Lipide um sich, die wahrscheinlich eine wichtige Rolle in der Funktion des Proteins haben.
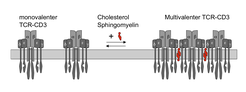
Schamel und seine Mitarbeiter konnten zeigen, dass Lipide eine wichtige Rolle bei der Antigen-unabhängigen Multimerisierung des TCR-CD3s spielen. Für die Untersuchungen wurden monovalente TCR-CD3s in Liposomen mit definierter Lipidzusammensetzung integriert. Nur wenn Cholesterol und Sphingomyelin zusätzlich zu Phosphatidylcholin anwesend waren, kam es zur Multimerisierung (Abb. 2). Auch in intakten Zellen spielt Cholesterol in wichtige Rolle, da Cholesterolextraktion zum Zerfallen der Rezeptoren führt. Die Lipidzusammensetzung der Plasmamembran könnte folglich wichtig sein für die Multimerisierung des TCRs und damit für die Sensitivität der T-Zellaktivierung.
T-Zell-Signaltransduktions-Netzwerk
Um das Verhalten des T-Zell-Signal-Netzwerks zu verstehen und besser vorhersagen zu können, ist es entscheidend, dieses als Gesamtsystem und nicht nur wie bisher in seinen einzelnen Teilen zu studieren. Traditionelle Forschungsansätze sind dazu nicht in der Lage. In der Schamel-Gruppe findet seit 2008 eine Neuorientierung zu leistungsfähigeren, systembiologischen Ansätzen statt. Als Auftakt wurde von Schamel das SYBILLA-Projekt „Systems Biology of T-cell activation in health and disease“ gegründet, das von der Europäischen Union im FP7 als „large collaborative project“ für fünf Jahre mit 11,1 Millionen Euro gefördert wird. Im Rahmen von SYBILLA wurden die Machbarkeit und der Erfolg systembiologischer Ansätze erfolgreich getestet. Zwei neue Methoden, um die Phosphorylierung von Proteinen zu messen, wurden etabliert. Die IP-FCM-Methode (Immunpräzipitation gemessen mit Durchflusszytometrie) [6], die quantitativ im Hochdurchsatz arbeitet, und Phostag-SDS- und BN-Gele [7; 8].
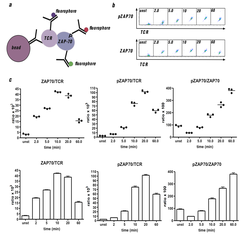
Für die IP-FCM werden die Zellen stimuliert und lysiert und Proteine von Interesse mit Antikörper-gekoppelten Latexbeads immunopräzipitiert. Co-präzipitierte Proteine oder post-translationale Modifikationen werden mit Fluoreszenz-markierten Antikörpern detektiert (Abb. 3). Die Messung erfolgt sehr exakt mit der quantitativen Multikanal-Durchflusszytometrie.
Weiterhin hat die Schamel-Gruppe sehr exakte Daten zur Bindung von monomeren und tetrameren Antigenen an monovalente und multivalente TCR-CD3s erhoben. Zusammen mit Theoretikern um Thomas Höfer aus Heidelberg wird nun ein mathematisches Modell entwickelt, das erklären soll, wie der TCR-CD3-Komplex Fremdstoffe von körpereigenen Stoffen unterscheiden kann.
Im Rahmen des SYBILLA-Projekts ist die Schamel-Gruppe in Phosphoproteom- und Interaktom-Projekte involviert. So sollen z. B. die Interaktome von 200 Signaltransduktions-Proteinen unter verschiedenen Stimulierungsbedingungen identifiziert werden.


