Weshalb es wichtig ist zu verstehen, warum wir dick sind
Forschungsbericht (importiert) 2014 - Max-Planck-Institut für Immunbiologie und Epigenetik
Metabolische Krankheiten und das 21. Jahrhundert
Der rasante Anstieg von Übergewicht in der Bevölkerung und die damit einhergehende Häufung von Folgeerkrankungen stellt eine große Herausforderung an unser Gesundheitssystem dar. Drei von vier stark übergewichtigen Menschen entwickeln diese Folgeerkrankungen, aber überraschenderweise bleibt der Stoffwechsel von einem Viertel langfristig gesund. Ein bislang unbekannter Grund dafür wurde nun in Zusammenarbeit mit Österreichischen Wissenschaftlern gefunden: das Enzym Hämoxygenase-1 (HO-1, [1]). Leber- und Fettbiopsien von fettleibigen Mäusen und Menschen, die in Zusammenarbeit mit der Medizinischen Universität Wien und der Paracelsus Privatuniversität in Salzburg untersucht wurden, zeigen unterschiedliche HO-1 Werte. Dabei zeigt sich, dass Personen mit niedrigen HO-1 Werten sehr selten Folgeerkrankungen entwickeln, während Personen mit hohen HO-1 Werten viel häufiger davon betroffen sind (Abb. 1). Diese Korrelation zwischen Folgeerkrankungen und HO-1 ist größer als zum Beispiel Gewicht, Fettanteil oder die Menge an Bauchfett. Das deutet darauf hin, dass HO-1 direkten Einfluss darauf hat, ob ein übergewichtiger Mensch Folgeerkrankungen entwickelt oder nicht.
Um diese Hypothese genauer zu durchleuchten, wurden in Zusammenarbeit mit Harald Esterbauer von der Medizinischen Universität Wien Untersuchungen an Knockout-Mäusen durchgeführt. Schaltet man das Enzym HO-1 in Makrophagen, also den Fresszellen des Immunsystems, aus, so bleiben diese Mäuse trotz starker Fettleibigkeit dauerhaft gesund und entwickeln nicht wie ihre genetisch unveränderten Geschwister Diabetes und Fettleber. Das Fettgewebe von genetisch unveränderten, übergewichtigen Mäusen zeigt hohe Ansammlungen von entzündungsfördernden Makrophagen, die Typ-2-Diabetes und chronische Entzündungen auslösen können. Wird das Enzym aber aus den Makrophagen entfernt, so unterbleiben diese Ansammlungen der Fresszellen und die Maus bleibt gesund.
HO-1 wurde daraufhin auch in Leberzellen ausgeschaltet, und auch das hatte einen positiven Effekt auf die Tiere. Selbst wenn diese Tiere über lange Zeit mit sehr energiereicher Nahrung gefüttert wurden und Fettleibigkeit entwickelten, sprachen die Leberzellen besser auf Insulin an und Leberschäden blieben aus. HO-1 fördert die Insulin-Resistenz in Leberzellen und damit Diabetes, indem es über Zwischenschritte die Insulin-Rezeptoren auf der Zelle verändert. Zudem ist die Aktivität der Mitochondrien, der zellulären Kraftwerke, in den Leberzellen ohne HO-1 deutlich höher - durch Nahrung aufgenommene Energie wird nicht in Form von Fett oder anderer Energieträger gespeichert, sondern schneller verarbeitet. Gleichzeitig zeigen die Mitochondrien eine erhöhte Produktion von Antioxidantien. Das reduziert direkt den Endzündungszustand des Immunsystems und gleichzeitig verstärkt es die Sensibilität des Körpers gegenüber Insulin - beides endscheidende Faktoren für einen metabolisch gesunden Zustand. Diese Ergebnisse widerlegen bisherige Studien, die vermuten, dass HO-1 ein entzündungshemmendes Enzym ist.
Unsere Studie bietet vielversprechende Ansätze für eine frühzeitige Diagnose und Therapie von Folgeerkrankungen bei Übergewicht. HO-1 könnte auch bei anderen Krankheiten eine zentrale Rolle spielen, die mit einer gestörten Funktion der Mitochondrien und Entzündungen einhergehen. Erste Ergebnisse für therapeutische Hemmstoffe werden in zwei bis drei Jahren erwartet.
Wie der Vater, so der Sohn

Übergewicht ist bis zu einem gewissen Grad vererbbar. Bisher wurden in sogenannten Genomweiten Assoziations-Studien (GWAS) in der Tat Bezüge zu wenigen bestimmten Genen hergestellt, doch kann der derzeitige Anstieg an Übergewichtigen in der Bevölkerung damit nicht erklärt werden. Es muss also noch eine andere Komponente geben, die für diese Zunahme verantwortlich ist. Umwelteinflüsse, so wurde inzwischen an vielen Beispielen gezeigt, können Genexpression verändern und diese Veränderungen können vererbbar sein, wobei der DNA-Code gleich bleibt. Dieses Phänomen wird als Epigenetik bezeichnet. In einer Studie zusammen mit Kollegen aus Spanien und Schweden zeigten wir, wie zu viel Zucker in der Ernährung von Fruchtfliegenvätern zu Übergewicht bei deren Söhnen führt [2]. Trotz der offensichtlichen Unterschiede zwischen Fliege und Mensch sind diese Ergebnisse relevant, denn die gleichen Veränderungen findet man beispielsweise auch bei eineiigen, also genetisch identischen Zwillingen, von denen einer Übergewicht entwickelt.
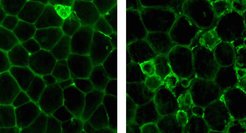
Wird Fruchtfliegenvätern Nahrung mit unterschiedlichem Zuckergehalt verabreicht, so bilden jene, die viel Zucker essen, mehr Körperfett. Untersucht man die männlichen Nachkommen dieser Tiere auf Fettleibigkeit, so sieht man, dass die Söhne von Vätern, die sehr wenig oder sehr viel Zucker aßen, dick werden, während die Söhne von Vätern, die normale Mengen an Zucker aßen, schlank bleiben. Drosophila als Modellorganismus für diese Untersuchungen hat viele Vorteile, einer davon ist das Vorhandensein von sogenannten position effect variegation (PEV) Stämmen. Diese geben Aufschluss über den Verpackungsstatus der DNA. DNA liegt nicht frei in der Zelle vor, sondern ist in bestimmten Proteinen, sogenannten Histonen, verpackt. Der Methylierungsstatus dieser Histonproteine wiederum bestimmt, wie fest verpackt die DNA ist. Je fester aber verpackt, desto weniger zugänglich sind die Gene, und desto weniger Protein wird von diesen Genen erzeugt - die Genexpression ist abgeschwächt. Führt man die oben erläuterten Versuche mit PEV-Stämmen durch, so erkennt man, dass die DNA von Nachkommen derjenigen Väter, die viel Zucker gegessen hatten, weniger fest verpackt ist. Führt man eine Sequenzierung der kompletten mRNA’s, also des Transkriptoms der Fliegen durch, so fällt auf, dass die veränderte Genexpression zwar auf große Abschnitte der DNA zutrifft, besonders aber auf jene, die spezifisch durch Histon-3-K9- und Histon-3-K27-Methylierung reguliert werden.
Um herauszufinden, welche Gene für eine Übertragung der Information von den Vätern auf die Söhne notwendig sind, wurden Versuche mit weiteren Mutanten durchgeführt. Gefunden wurde, dass Enzyme, die die Methylierung von Histon-3-K9 und Histon-3-K27 vermitteln, essenziell für die Vererbung der Fettleibigkeit sind. Diese Enzyme - für eine feste Verpackung der DNA verantwortlich - sind in den übergewichtigen Nachkommen weniger stark exprimiert (Abb. 2). Dass diese Ergebnisse auch für uns Menschen relevant sind, zeigen Resultate anderer Studien, die sich der Fettleibigkeit von Mäusen und Menschen widmeten. Dieselben Gene, die für die feste Verpackung von DNA verantwortlich sind, sind auch in übergewichtigen Mäusen und Menschen weniger exprimiert.
Ausblick
Dank der oben vorgestellten Studien kann nun besser verstanden werden, warum manche übergewichtige Menschen Folgeerkrankungen entwickeln und manche nicht. Es wäre interessant zu wissen, für welche anderen Krankheiten der Mechanismus von HO-1 bestimmend ist. Aktuell sollte der Fokus nun auch parallel in der Entwicklung von Medikamenten liegen. Die Studie mit den Fliegen zeigt, warum manche von uns Übergewicht entwickeln und welchen Einfluss unsere Väter darauf haben könnten. Es wäre also ebenfalls und besonders interessant zu überprüfen, welche anderen Eigenschaften auf diese Art und Weise vererbbar sind und wie man diese Vererbung unterbinden beziehungsweise auch nutzen könnte.

