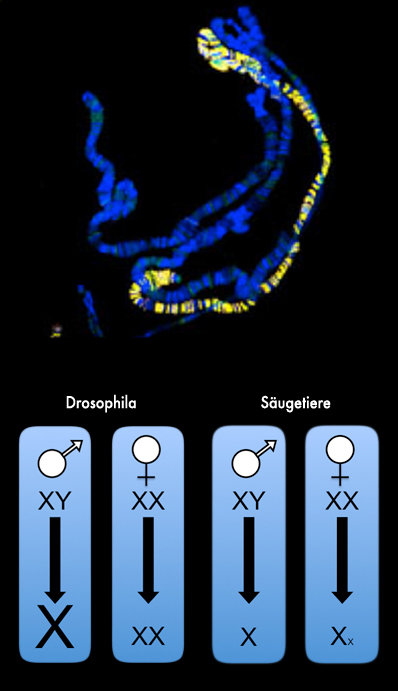
Dosiskompensation: Logistik auf dem X-Chromosom
Forscher haben entdeckt, wie Fliegen die Menge an Genprodukten des X-Chromosoms in beiden Geschlechtern anpassen
Wenn wir Waren im Internet bestellen, so sind wir häufig davon beeindruckt, wie schnell diese zu uns nach Hause geliefert werden. Dies ist möglich geworden, weil Paketdienste eine sehr zuverlässige und effiziente Logistik mit zentralen Versandzentren zur optimalen und schnellen Verteilung von Paketen entwickelt haben. Wissenschaftlern des Max-Planck-Instituts für Immunbiologie und Epigenetik ist es nun gelungen, eine vergleichbare Logistik für die Dosiskompensation bei Fliegen nachzuweisen. Durch die Kombination von modernsten molekularen Techniken und bildgebenden Verfahren waren die Forscher in der Lage, den Mechanismus der Verteilung des für die Dosiskompensation verantwortlichen Proteinkomplexes genauer zu beschreiben. Dabei konnten sie beobachten, dass die sogenannten „high-affinity sites“ (HAS) – wichtige Bindungsregionen für diesen Proteinkomplex – häufig in Bereichen des X-Chromosoms auftreten, die gut untereinander und mit anderen Bereichen des Chromosoms vernetzt sind. HAS sind somit wichtige Versandzentren, die ein Verteilen des Proteinkomplexes über das gesamte X-Chromosom erleichtern.
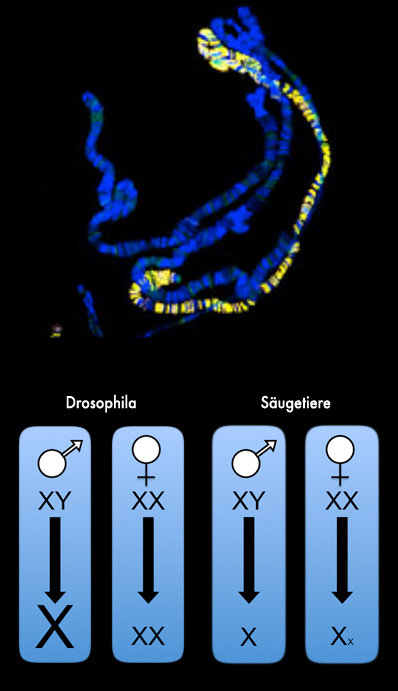
Die Ausbildung des Geschlechts wird bei Säugetieren wie auch anderen Spezies über zwei spezielle Chromosomen gesteuert: die X- und Y-Chromosomen. Weibchen (XX) besitzen zwei X-Chromosomen. Männchen (XY) hingegen haben nur ein X-Chromosom. Da es aber entscheidend ist, dass die Menge an Genprodukten des X-Chromosoms in beiden Geschlechtern gleich hoch ist, hat sich ein molekularer Ausgleichmechanismus entwickelt: die Dosiskompensation. Bei Säugetieren wird so beispielsweise eines der beiden X-Chromosomen des Weibchens stillgelegt („X-Inaktivierung“). Anders bei Fliegen: Hier wird die Genexpression des männlichen X-Chromosoms um das Zweifache gesteigert, damit die gleiche Menge an Genprodukten wie bei den Weibchen erreicht wird.
Dieser Mechanismus der Dosiskompensation ist bei Drosophila melanogaster bereits vielfältig untersucht worden. Es ist daher bekannt, dass die Dosiskompensation über einen speziellen Komplex von Proteinen und nicht-kodierender DNA herbeigeführt wird: dem sogenannten MSL-Komplex. Um die Dosiskompensation zu erreichen, muss nun das Protein-„Paket“ über das gesamte X-Chromosom verteilt werden. Dafür wird der MSL-Komplex an spezielle Regionen des Chromosoms gebunden. Von diesen als „high-affinity sites“ (HAS) bezeichneten Loci breitet sich dieser dann über das restliche Chromosom aus. „Obwohl wir die Pakete, die Versandzentren und auch die Lieferorte kannten, war uns die konkrete Funktionsweise der Logistik noch unvertraut. Wir fragten uns, ob die „high-affinity sites“ nicht bestimmte räumliche Eigenschaften aufweisen, die für die Regulation des X-Chromosoms von Bedeutung sein könnten“, merkt die leitende Autorin Asifa Akhtar an.
Die neue Studie des Labors von Asifa Akhtar vom Freiburger Max-Planck Institut für Immunbiologie und Epigenetik macht deutlich, dass diese Fragen über die räumlichen Eigenschaften der „high-affinity sites“ und deren Rolle für die Dosiskompensation nur beantwortet werden können, indem – wortwörtlich – eine weitere Dimension berücksichtigt wird. Zusammen mit dem Labor von Job Dekker (UMass Medical School, Worcester, USA) sowie dem Labor von Wouter de Laat (Hubrecht Institute, Utrecht, Netherlands) – beide Teams sind ausgewiesene Spezialisten für die Analyse der dreidimensionalen Organisation des Genoms – gelang es, die „high-affinity sites“ in der 3D-Struktur des Chromosoms zu verorten.
„Die Zusammenarbeit war hervorragend und wichtig für die Arbeit an diesem Projekt“, sagt Fidel Ramírez, einer der Erstautoren der Studie. „Als wir vor über drei Jahren mit dem Projekt starteten, mussten wir ganz neue Instrumente und Analysemethoden entwickeln, um die strukturellen Eigenschaften und die räumliche Ordnung der Chromosomen zu untersuchen. Das heißt, wir benötigten ganz neue und zugleich sehr schnelle Algorithmen und Techniken zur Visualisierung, um den zahlreichen erhobenen Daten gerecht zu werden.“
So wurde es erst durch die Kombination der 3D-Daten mit neuesten bildgebenden Verfahren sowie dem Einsatz von Drosophila-Genetik möglich zu zeigen, dass die „high-affinity sites“ im 3D-Modell nicht nur in enger räumlicher Nähe zueinander liegen, sondern auch gut vernetzt mit anderen Bereichen des X-Chromosoms sind. „Die Ergebnisse zeigen, dass Drosophila melanogaster einen eleganten molekularen Mechanismus entwickelt hat, um den MSL-Komplex für die Dosiskompensation in andere Bereiche des X-Chromosoms zu befördern. Die Lage der „high-affinity sites“ in strategisch günstigen Regionen ermöglicht eine effiziente Verteilung des Komplexes zu den aktiven Genen“, sagt Asifa Akhtar.
Der von den Freiburger Forschern beschriebene Mechansimus erinnert Sarah Toscano, eine der Erstautoren, an einen modernen Paketdienst: „Die Verteilung des MSL-Komplexes für die Dosiskompensation ist mit der Logistik eines Versanddienstes zu vergleichen. Dabei fungieren die „high-affinity sites“ als wichtige Versandzentren. Sie sind an strategisch sinnvollen und einfach zu erreichenden Orten platziert und ermöglichen eine schnellen und reibungslosen Zustellung der Pakete zu den Zieladressen.“
Die nun vorgestellten und umfangreich dokumentieren Ergebnisse ermöglichen zugleich spannende Perspektiven für weitere Forschungen. Die Autoren vermuten, dass der nun anhand der Dosiskompensation dargestellte molekularen Mechanismus auch für andere Szenarien der Chromatin-Regulierung in Frage kommen könnte. Gleichzeitig bieten sich somit auch wichtige Ansatzpunkte, die Ähnlichkeiten und Unterschiede vergleichbarer Verteilungsmechanismen auf dem menschlichen X-Chromosom näher zu untersuchen. Denn obgleich die Pakete und die Lage der Versandzentren in menschlichen Zellen andere sind, könnte die Logistik an sich mit der der Fliege vergleichbar sein.
MR/HR