Vererbung über die DNA hinaus: Epigenetische Vererbung zwischen Generationen
Forschungsbericht (importiert) 2017 - Max-Planck-Institut für Immunbiologie und Epigenetik
Epigenetische Regulierung der Zellidentität

Der menschliche Körper besteht aus mehr als 250 verschiedenen Zelltypen, die alle über dasselbe Genom verfügen. Eine der Erklärungen dafür, dass Zellen mit demselben Genom völlig verschiedene Identitäten annehmen können - eine Leberzelle erfüllt völlig andere Aufgaben als eine Muskelzelle, trotzdem verfügen beide über dieselbe DNA-Matrize – ist die sogenannte Epigenetik. Epigenetische Modifikationen sind reversible chemische Veränderungen der DNA oder der Histone, das sind Proteine, die die DNA verpacken. Diese chemischen Veränderungen sorgen dafür, dass Proteine, die die Genexpression vermitteln, angezogen oder abgestoßen werden. Auf diese Weise können epigenetische Modifikationen Genexpression beeinflussen und die jeweils spezifischen Expressionsmuster der verschiedenen Zelltypen definieren.
Zu jeder epigenetischen Modifikation gehört ein Enzym, das Modifikationen an der DNA oder den Histonen bedingt, diese Enzyme werden als writer bezeichnet. Es gibt weitere Enzyme, die Modifikationen entfernen (eraser) oder lesen (reader) können. Das Zusammenspiel dieser drei Proteinklassen an jeder Modifikation sorgt dafür, dass epigenetische Modifikationen zum einen streng reguliert sind, zum anderen, im Gegensatz zur „starren“ DNA-Sequenz, aber auch schnell verändert werden können. Epigenetische Modifikationen können sich daher im Laufe unseres Lebens je nach Anpassung an unsere Umwelt oder unseren jeweiligen Lebensstil verändern, und äußere Einflüsse wie Stress, Krankheit oder Ernährung können Einfluss auf das epigenetische Programm der Zellen nehmen.
Epigenetische Vererbung zwischen Generationen
Die epigenetische Information unterscheidet sich zwischen Individuen, aber man geht davon aus, dass die während des Lebens angesammelten epigenetischen Informationen während der Entwicklung von Spermien und Eizellen wieder gelöscht werden. Dieses Paradigma wiederum wurde in den letzten Jahrzehnten immer wieder durch Hinweise, dass zum Beispiel Stress-bedingte Chromatinveränderungen zwischen Generationen vererbt werden können, angefochten. Epidemiologische Studien konnten eine beeindruckende Korrelation zwischen der Ernährung von Eltern und dem Auftreten von Diabetes oder kardiovaskulären Erkrankungen in den Nachfahren enthüllen. Neuere Studien zeigen Beispiele für epigenetische Vererbung in verschiedenen Modellorganismen, allerdings sind die zugrundeliegenden molekularen Mechanismen noch immer unbekannt [1-3].
Untersuchung der frühen Embryonalentwicklung
Um die molekularen Mechanismen epigenetischer Vererbung zu verstehen, können Embryos insbesondere im Verlauf ihrer frühen Entwicklung dienen. Die dabei häufig verwendeten mikroskopischen Analysen verschiedener Modellorganismen geben jedoch nur wenig Aufschluss darüber, was während der Verschmelzung der Gameten und den nachfolgenden frühen Zellteilungen auf molekularer Ebene passiert. Eine zusätzliche Hürde bei der Verwendung früher Embryos ist die stets geringe Menge an verfügbarem biologischem Material.
Ein alternativer Forschungsansatz, nämlich herauszufinden, welche Rolle ausgewählte Enzyme bei epigenetischen Abläufen spielen, indem die dazugehörigen Gene inaktiviert werden, führt bedauerlicherweise oft zu Defekten in der Keimbahn, sodass gar keine Gameten gebildet und somit die Rolle des entsprechenden Genproduktes nicht untersucht werden kann. Aus diesen Gründen wurde die frühe Embryonalentwicklung auf molekularer Ebene bisher nur sehr wenig erforscht.
H3K27me3 wird durch die mütterliche Keimbahn vererbt und reguliert die Genexpression während der embryonalen Genomaktivierung
Um die Rolle verschiedener Chromatinproteine während der frühen Embryonalentwicklung von Drosophila melanogaster, der Fruchtfliege, zu untersuchen, hat unser Labor verschiedene molekulare Techniken etabliert, die es erlauben, biochemische Analysen mit sehr geringen Mengen biologischen Materials durchzuführen. Zudem ist es vergleichsweise einfach, Drosophila mit Hilfe genetischer Methoden zu untersuchen. Es wurde ein auf RNAi basiertes genetisches Screening durchgeführt, das den als PRC2 bezeichneten Komplex als essentiellen Faktor der frühen Embryonalentwicklung identifizierte. PRC2 katalysiert die Trimethylierung von Histon H3 am Lysin 27 (H3K27me3), und diese Modifikation ist mit fakultativem Heterochromatin und transkriptioneller Stilllegung von Genen assoziiert. Es zeigte sich, dass H3K27me3 am Chromatin der Eizelle erhalten bleibt und somit durch die mütterliche Keimbahn an den Embryo vererbt wird (Abb. 1; [4]). Diese Modifikation bleibt bis zur embryonalen Genomaktivierung und darüber hinaus auf dem embryonalen Chromatin nachweisbar. Mithilfe der Chromatin-Immunopräzipitation (ChIP) war es zum ersten Mal möglich, die genomweite Verteilung von H3K27me3 in totipotenten, pluripotenten und Blastoderm Embryonalzellen zu kartieren. Dieses Ergebnis ist überraschend, denn es zeigt, dass frühes embryonales Chromatin, anders als bisher angenommen, bereits zu einem gewissen Grad strukturiert ist und PRC2-regulierte Domänen enthält.
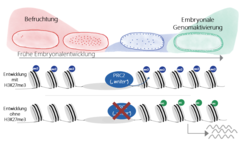
Darüber hinaus konnte gezeigt werden, dass die mütterliche Vererbung von H3K27me3 essentiell für die Embryonalentwicklung ist. Embryos, die sich ohne H3K27me3 entwickeln, zeigen Anreicherungen einer Acetylierung am Lysin 27. Werden reprimierend wirkende H3K27me3 Domänen mit der aktivierend wirkenden H3K27ac-Modifikation ersetzt, führt dies zur Fehlexpression von Entwicklungsgenen mit der Folge, dass das Entwicklungsprogramm fehlerhaft verläuft und zum Tod der Embryos führt (Abb. 2).
Die mütterliche Vererbung von H3K27me3 ist ein evolutionär konservierter Mechanismus, um die Genexpression während der frühen Entwicklung zu regulieren [5]. Für die zukünftige Forschung stellt sich jetzt die Frage, wie bestimmte Positionen im Genom durch H3K27me3 geprägt werden und wie diese den frühen remodelling Prozessen entgehen.

