Zu den Wurzeln der akuten myeloischen Leukämie
Neue Erkenntnisse über die Rolle des Transkriptionsfaktors HLX bei Blutkrebs
Akute myeloische Leukämie oder kurz AML ist eine bösartige Erkrankung des Knochenmarks. Trotz intensiver Erforschung bestehen für diese Blutkrebsart nur geringe Heilungschancen. Am Freiburger Max-Planck-Instituts für Immunbiologie und Epigenetik in Freiburg ist es einem Forschungsteam nun gelungen, die konkrete Funktion des Transkriptionsfaktors HLX aufzuklären, der bei Mehrzahl der an AML erkrankten Patienten überaktiviert ist. Das Team um Gruppenleiterin Eirini Trompouki wies nach, dass HLX verstärkt Stoffwechselgene beeinflusst, die in den betroffenen Vorläuferzellen des menschlichen Blutes eine Blockade der Zelldifferenzierung verursachen. Die Studie legt mit ihren Ergebnissen zudem erste Grundlagen für neue Therapieansätze der AML-Erkrankung.
Die akute myeloische Leukämie (AML) ist eine der häufigsten akuten Blutkrebsarten bei Erwachsenen. Die Krankheit wird durch genetische Mutationen von blutbildenden Zellen im Knochenmark verursacht. Die veränderte Zelle im Falle einer AML-Erkrankung ist die Myeloblast-Zelle. Dabei handelt es sich um eine noch unreife Vorläuferzelle weißer Blutkörperchen, die ihre Fähigkeit zur Ausreifung verloren hat. Bei erkrankten Patienten wachsen und teilen sich diese bösartig veränderten Zellen so rasant, dass sie die gesunden Zellen aus dem Knochenmark und schließlich auch aus dem Immunsystem verdrängen.
Trotz erheblicher Fortschritte bei therapeutischen Ansätzen überleben nur 26 Prozent der Patienten länger als fünf Jahre diese aggressive Form des Blutkrebs. Einer der Gründe für die geringen Therapieerfolge liegt unter anderem an der Komplexität der Erkrankung. Sie beruht in vielen Fällen auf der Heterogenität einzelner Mutationen, die jeder individuelle Patient trägt. Die Identifizierung individuellen Mutationen für jeden Patienten soll zukünftig Teil neuer „maßgeschneiderter” Therapieansätze sein. Aus diesem Grund arbeiten weltweit Wissenschaftler daran, die Funktionsweise der an der Krankheit beteiligten Gene zu erforschen, sodass den Patienten künftig durch bessere und personalisierte Behandlungen geholfen werden kann.
Zentraler Faktor für AML
Auch das Labor von Eirini Trompouki am Max-Planck-Institut für Immunbiologie und Epigenetik erforscht verschiedene genetische Faktoren von Leukämieerkrankungen sowie des blutbildenden Systems. In ihrer neuesten Studie schlägt das Team aber einen leicht anderen Weg ein. Anstatt je individuelle Mutationen von Genen zu identifizieren, widmeten sie sich der genaueren Untersuchung eines zentralen Faktors, der bei vielen AML-Erkrankungen involviert ist. Dieser sogenannte Transkriptionsfaktor HLX spielt, wie die Max-Planck-Forscher vermuteten, möglicherweise eine wichtige Rolle bei der Erkrankung.
Anfänglich waren die Labormitglieder überrascht, dass trotz zahlreicher Studien zur AML der exakte Wirkmechanismus des Transkriptionsfaktor HLX, der bei 87 Prozent der AML-Patienten in abnormal hohen Konzentrationen exprimiert wird, noch immer weitgehend unbekannt ist. Transkriptionsfaktoren sind spezifische Proteine, die an die DNA binden. Sie ähneln genetischen Lichtschaltern und können Gene ein- und ausschalten. In Mäusen konnte HLX bereits mit einer Blockade während der Zelldifferenzierung von Myeloblasten in Verbindung gebracht werden, aber es blieb bisher unklar, wie genau der Faktor funktioniert und vor allem welche Rolle er in gesunden oder leukämischen Zellen des Menschen spielt.
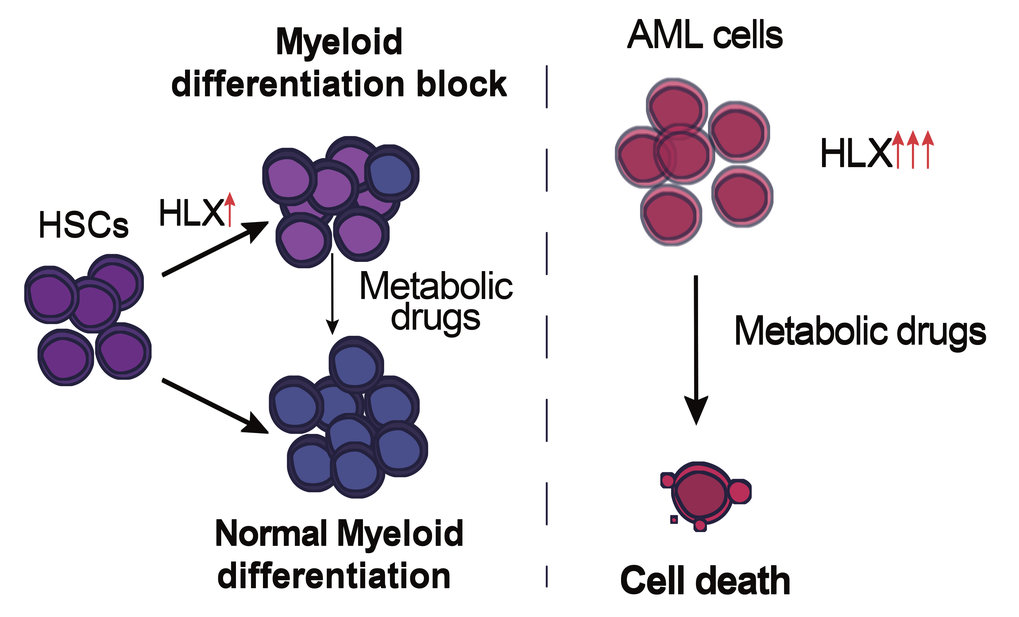
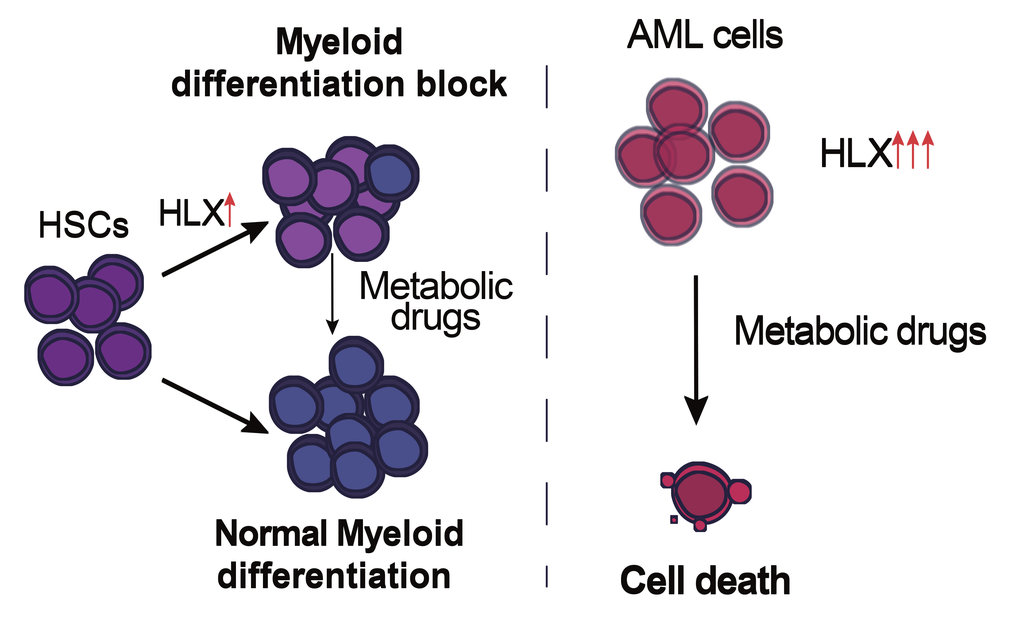
„Um die Komplexität anfänglich zu reduzieren, da Krankheit ja durch mehrere deregulierte Signalwege verursacht wird, und um die Rolle dieses Faktors im blutbildenden System zu untersuchen, haben wir uns ganz bewusst dazu entschieden, zu den Ursprüngen zurückzukehren. Wir wollten zunächst wissen, welche Aufgaben HLX im gesunden Organismus übernimmt”, sagt Eirini Trompouki, die das Projekt konzipierte und leitet. Die Wissenschaftler setzten dabei auf Zebrafisch-Embryonen, in deren Aorta Blutstammzellen gebildet werden, sowie auf humane hämatopoetischen Stamm- und Vorläuferzellenlinien (HSPCs). Dort überexprimierten sie das menschliche HLX-Gen, d.h. sie sorgten für ein künstlich herbeigeführtes, verstärktes Ablesen, um die Auswirkungen des Gens genau zu studieren. In beiden Fällen zeigte sich anschließend eine Blockade der Zelldifferenzierung von Myeloblasten, was mit den Auswirkungen von HXL bei den verschiedenen myelogenen Leukämieformen übereinstimmt.
HLX reguliert Energiepotential der Zelle
Um die für die Studie zentrale Frage aufzuklären, welche Gene der Transkriptionsfaktor HLX nun genau reguliert und wie sich das konkret auf die Zellen auswirkt, kombinierten die Wissenschaftler mehrere genomweite Techniken sowohl im Modellorganismus Zebrafisch als auch in menschlichen Zelllinien. „Wir haben eine Reihe von genomweiten Datensätzen erstellt, die das molekulare Profil von Zellen zeigen, in denen HLX überexprimiert oder gar nicht vorhanden ist. Dabei war in all unseren Daten die Fehlregulation des Stoffwechsels der Zellen auffällig“, sagen Indre Piragyte und Aikaterini Polyzou, Erstautorinnen der Studie. Und ihr Kollege Thomas Clapes ergänzt: „Wir konnten auch Analysen durchführen, die zum ersten Mal die Gene zeigen, die direkt von HLX reguliert werden. Unsere Ergebnisse weisen deutlich aus, dass HLX Stoffwechsel-Gene beeinflusst.“ Insbesondere fand das Team Deregulierungen der Gene der Elektronentransportkette, die sich in den Mitochondrien befinden, sowie Fehlsteuerungen des Peroxisomproliferator-aktivierten Rezeptors (PPAR) und des Stoffwechselsensors AMPK, die beide für die Steuerung des Stoffwechsels in den Zellen wichtig sind.
„Die Tatsache, dass die Stoffwechselregulation sowohl in gesunden als auch kranken Zellen des hämatopoetischen System eine so zentrale Rolle hat, ist letztlich wenig überraschend. Das Stoffwechselprofil ist bei gesunden Vorläuferzellen aber auch bei Krebszellen ein entscheidender Faktor für deren Schicksal und Funktion“, erklärt Eirini Trompouki. Die Freiburger Forscher testeten auch, ob die von HXL regulierten Stoffwechselwege durch Medikamente beeinflusst werden können. Konkret erhofften Sie sich, dass so die Blockade während der Zelldifferenzierung der Myeloblasten gelöst oder aber die Überlebensrate der Krebszellen verringert werden kann.
Mögliche Behandlung von AML-Patienten
In ihren Experimenten mit verschiedenen AML-Zelllinien entdeckten sie überraschenderweise, dass die Funktion des durch HLX aktivierten Stoffwechselsensor AMPK mit Medikamenten gehemmt werden kann und so die Überlebensrate der Krebszellen deutlich reduziert wird. Gleichzeitig, und dies ist möglicherweise wichtig für zukünftige Therapien, zeigten sich gesunde Vorläuferzellen mit überaktiviertem HLX, nahezu unbeeindruckt von der Behandlung. „Die Modulation des Zellstoffwechsels ist in vielen Bereichen der Krebstherapie bereits in der Erprobung. Wir sind uns sicher, dass die Ergebnisse zu HLX und die Erkenntnisse zur medikamentösen Hemmung von AMPK zukünftig auch zur Behandlung von AML-Patienten beitragen könnten. Unsere Studie legt eine Grundlage für mögliche Therapieoptionen, die weiter erforscht werden sollten“, sagt Eirini Trompouki.