Starker Dämpfer für Genaktivität
Wie Zellen unter Stress Gene abschalten
Als Reaktion auf Belastungen wie Hitzeschocks starten Zellen eine koordinierte Reaktion, um sich vor Schäden zu schützen. Teil dieser ist eine schnelle Dämpfung der Aktivität einer Vielzahl von unter normalen Bedingungen aktiven Genen in einem Prozess, der von den Wissenschaftlern als stress-induced transcriptional attenuation (SITA) bezeichnet wird. Wie dieser Prozess funktioniert, haben Freiburger Forscher des Max-Planck-Instituts für Immunbiologie und Epigenetik nun gezeigt. Die Ergebnisse des Labors von Ritwick Sawarkar, ERC-Preisträger 2018, haben zudem Relevanz für die Erforschung und Therapie neurodegenerativer Krankheiten wie die Huntington-Krankheit.
Wenn es zu einem Großbrand in einer belebten Metropolregion kommt, wird der Tagesablauf abrupt unterbrochen. Rettungskräfte eilen zum Brandort, während der normale Berufsverkehr mit Autos, Taxis und Bussen zum Stillstand kommt. Etwas Ähnliches kann auch in unseren Zellen beobachtet werden.
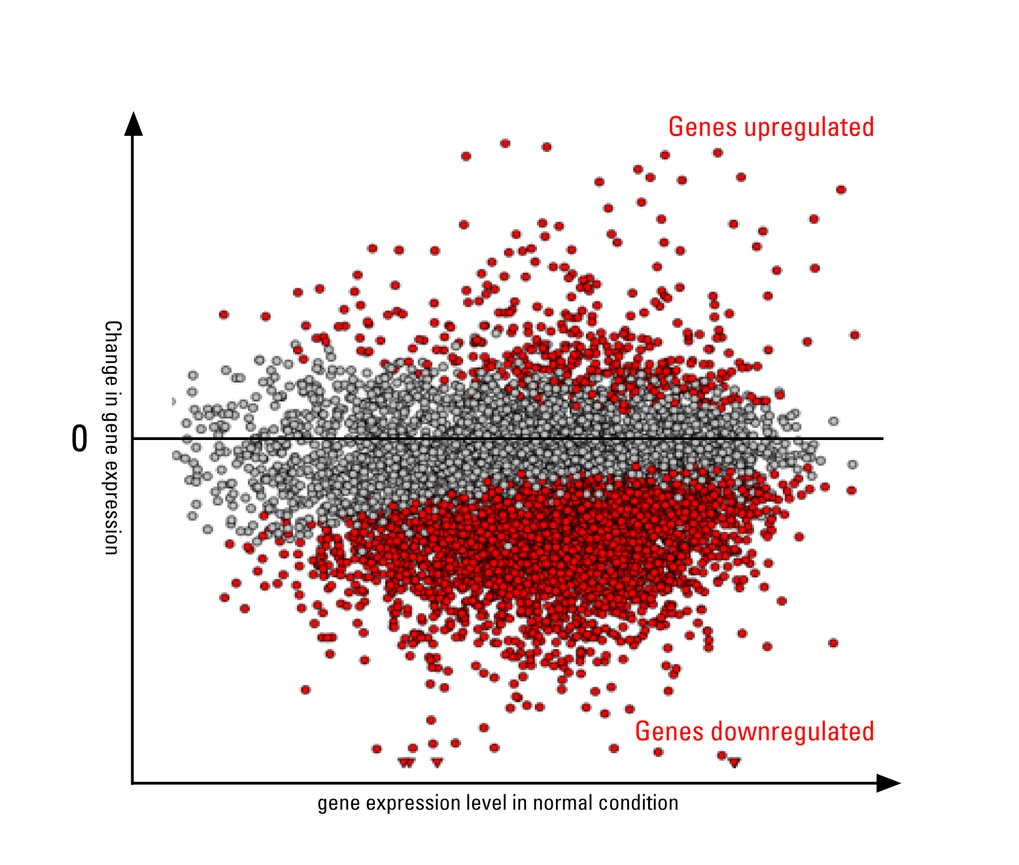
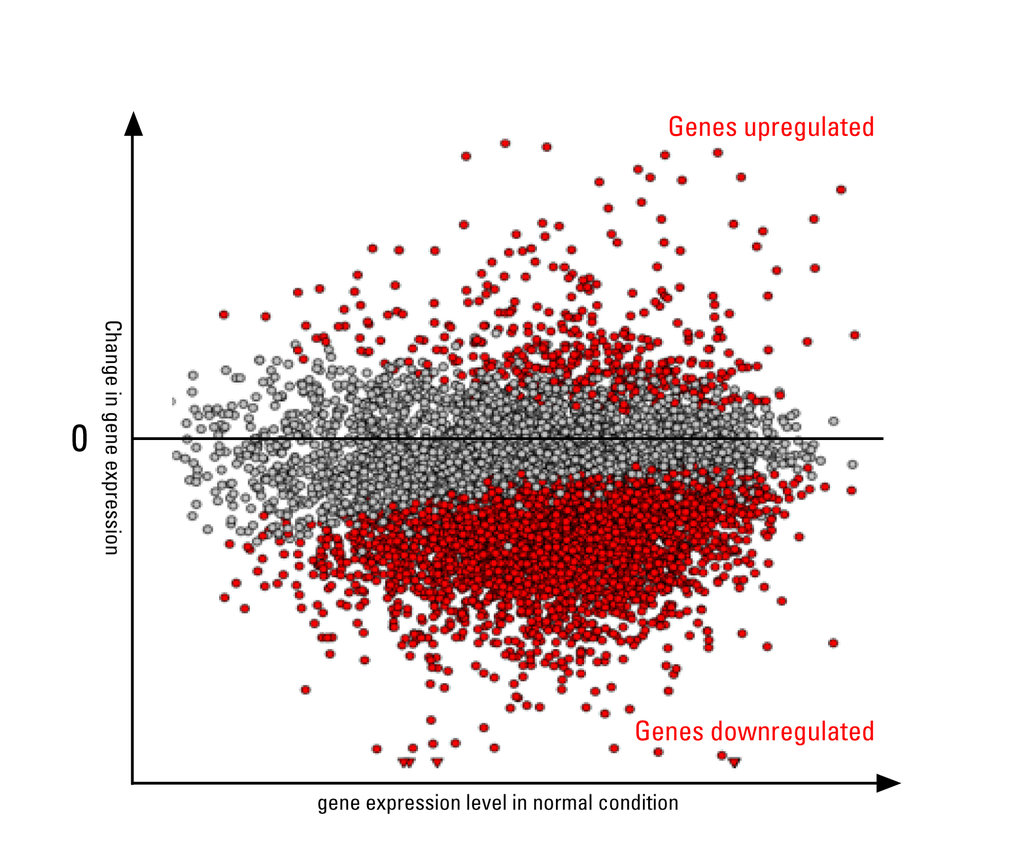
Als Reaktion auf Stressereignisse wie etwa hohe Temperaturen, Nährstoffmangel oder Infektionen mit Krankheitserregern unterbrechen Zellen ihre tägliche Routine, um sich vor Schäden zu schützen. Bei einem Hitzeschock beispielsweise ergreifen Zellen sofort Gegenmaßnahmen. Sie beginnen mit der Produktion bestimmter Eiweiße, um andere in Mitleidenschaft geratene Eiweißen zu stabilisieren. Gleichzeitig wird aber auch die Transkription, also die Herstellung von RNA aus dem DNA-Material, bei einer Vielzahl von unter normalen Bedingungen aktiven Genen stark heruntergefahren.
SITA – eine stress-induzierte Dämpfung der Gentranskription
„Dieses stressbedingte Dämpfen der Aktivität vieler Gene gleichzeitig – oder wie wir es nennen Stress-Induced Transcriptional Attenuation (SITA) – ist ein Phänomen, das wir in den Zellen von Fruchtfliegen, Mäusen und Menschen beobachten können. Jedoch ist wenig darüber bekannt, welche Mechanismen von den Zellen für SITA genutzt werden“, sagt Gruppenleiter Ritwick Sawarkar. Ein klassisches Modell zur Untersuchung derartiger Veränderungen der Gentranskription bei Stress sind Hitzeschockexperimente. Dabei setzt das Freiburger Forschungsteam am Max-Planck-Instituts für Immunbiologie und Epigenetik menschliche Zellen einem akuten Temperaturanstieg aus und analysiert anschließend die Proben mit molekularen und biochemischen Techniken.
Nachdem die Freiburger Wissenschaftler die Zellen „gestresst“ hatten, konnten sie Schritt für Schritt den molekularen Signalweg nachvollziehen, der zu SITA führt. „Wir haben zunächst identifiziert, wer den Verkehr stoppt. Ein Eiweißkomplex mit dem Namen NELF ist dafür verantwortlich. Er bindet an die Gene der DNA, stoppt die Herstellung von RNA und verhindert dadurch die Aktivität der Gene“, erläutert Fernando Aprile-Garcia, Erstautor der Studie.
Wie wird SITA ausgelöst?
Aber die Wissenschaftler fragten sich, wie die Zelle überhaupt das Stressereignis erkennt und der Eiweißkomplex aktiviert wird? Das Team stellte fest, dass in Stress versetzte Zellen Eiweiße produzieren, die mit einer sogenannten Ubiquitin-Markierung gekennzeichnet sind. „Unsere Daten legen nahe, dass die Zunahme der mit Ubiquitin-Markierungen produzierten Eiweiße das entscheidende Signal für die Zellen ist, um den Stress zu erkennen“, sagt Aprile-Garcia.
Im Folgenden übernimmt die Kinase p38α die Übermittlung des Stresssignals an die DNA im Zellkern. Das Molekül wird aus dem Cytosol, wo die Eiweiße entstehen, zum Zellkern verlagert. „Hier bindet es an die gleichen Gene wie der NELF-Eiweißkomplex. Daher ist p38α der Botenstoff, der das Stresssignal an den Kern weiterleitet, um die Genaktivität zu verändern“, sagt Aprile-Garcia.
Dämpfung der Gentranskription auch bei der Huntington-Krankheit
Die Ergebnisse der Studie tragen zu einem besseren Verständnis der Zellbiologie bei, könnten aber auch Auswirkungen auf das biomedizinische Forschungsfeld um neurodegenerative Erkrankungen haben. Denn die Freiburger Forschen entdeckten, dass Schlüsselmerkmale von SITA wie die Eiweiß-Ubiquitinierung und die Dämpfung der Gentranskription auch in zellulären Modellen der Huntington-Krankheit vorkommen. „Dies ermutigte uns, postmortale Hirngewebeproben von Huntington-Patienten zu untersuchen. Zu unserer Überraschung zeigt sich, dass die überwiegende Mehrheit der Gene, die ihre Aktivität in unseren Hitzeschock-Experimenten verringern, auch in den Gewebeproben der Huntington-Patienten eine verringerte Aktivität zeigen“, sagt Aprile-Garcia.
Obgleich noch viele Fragen ungeklärt sind und es noch weiterer Forschung bedarf, um die mögliche Rolle von SITA bei neurodegenerativen Erkrankungen zu verstehen, hoffen Forscher, dass ihre Erkenntnisse den Weg ebnen für zukünftige Ansätze bei der Therapie neurodegenerativer Erkrankungen.
MR