Immuntoleranz im Darm
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Immunbiologie und Epigenetik
Warum braucht das Immunsystem Toleranz?
Das Immunsystem hat die Aufgabe, uns vor Krankheitserregern zu schützen. Das wirft jedoch die Frage auf: Wie kann der Organismus Krankheitserreger von nicht pathogenen Strukturen unterscheiden?
Ein eleganter Lösungsansatz wäre es, „Eigenstrukturen“ zu tolerieren und „Fremdstrukturen“ zu attackieren. Leider ist die Realität nicht so einfach. Zum Beispiel müssen unkontrolliert proliferierende körpereigene Krebszellen erkannt und beseitigt werden. Auf der anderen Seite sind unsere Haut und der Darm ein Lebensraum für unzählige Mikroorganismen. Diese sind zwar körperfremd, aber nicht per se schädlich; sie können für den Wirt sogar sehr nützlich sein. Es mehren sich Hinweise, dass das Immunsystem große Anstrengungen unternimmt, um abzuwägen, was bekämpft werden soll und was nicht. Werden Pathogene nicht beseitigt, könnte der Wirtsorganismus im schlimmsten Fall sterben. Wenn das Immunsystem sich allerdings in einen Kampf gegen harmlose oder sogar nützliche Organismen stürzt, könnten die körpereigenen Gewebe dabei in Mitleidenschaft gezogen werden – zum Nachteil des Wirtsorganismus. Die Beseitigung von nützlichen Organismen würde auch schwere Folgen haben. Fehlgeleitete Immunantworten sind bei Menschen für schwere Erkrankungen wie Autoimmunität, Allergien und chronische Entzündungen verantwortlich.
Vor einigen Jahren wurde ein Zelltyp identifiziert, der eine wesentliche Rolle bei der Toleranz sowohl von körpereigenen als auch von Fremdstoffen spielt. Hierbei handelt es sich um die regulatorischen T-Zellen [1].
Foxp3 und regulatorische T-Zellen
T-Zellen sind ein Typ von weißen Blutkörperchen, die im Thymus entstehen (daher das „T“). T-Zellen sind dadurch gekennzeichnet, dass jede Zelle auf der Oberfläche Rezeptoren für ein einziges, bestimmtes Antigen trägt. Jede im Thymus entstehende T-Zelle erkennt daher durch ihre Rezeptoren ein anderes Antigen. Diese Rezeptoren sollen spezifisch für Krankheitserreger sein und die gesamte Population von T-Zellen soll ein breites Spektrum an möglichen Bindungspartnern abdecken. Hierfür werden nach dem Zufallsprinzip Rezeptoren geformt, die an der Zellmembran der noch jungen T-Zellen präsentiert werden. In einem weiteren Schritt wird im Thymus überprüft, ob die T-Zelle körpereigene Strukturen erkennt. Die T-Zellen, deren Rezeptor keine körpereigenen Strukturen erkennt, entwickeln sich weiter und emigrieren aus dem Thymus in die Peripherie. Falls der T-Zellrezeptor auf der jungen T-Zelle allerdings körpereigene Strukturen bindet, wird entweder ein programmiertes Selbstmordprogramm abgespielt oder aber eben diese Zelle differenziert sich weiter in eine regulatorische T-Zelle. Während klassische T-Zellen nach erfolgter Stimulierung ihres Rezeptors eine Entzündung hervorrufen können, versuchen regulatorische T-Zellen die Entzündung einzudämmen, wenn sie ihr Antigen erkennen.
Die regulatorischen T-Zellen und ihre Aktivität wurden zuerst in der Maus charakterisiert, aber es wurde bald deutlich, dass sie auch beim Menschen vorhanden sind und dort eine wesentliche Rolle spielen. Charakterisiert wurden regulatorische T-Zellen durch die konstitutive Expression des Transkriptionsfaktors Foxp3. Mäuse, die eine Mutation im Gen Foxp3 haben, können keine regulatorischen T-Zellen bilden und sterben an einer unkontrollierten Entzündung, die mehrere Organe betrifft. Gleicherweise leiden Menschen, die Mutationen im Gen FOXP3 aufweisen, an einer schweren und oft tödlichen Autoimmunerkrankung [2].
Der Darm als Modellorgan für antigenspezifische Immuntoleranz
Der Darm ist ein Organ, bei dem die Entscheidung zwischen Entzündung und Toleranz außerordentlich wichtig ist [3]. Hier werden die Nährstoffe aus der Nahrung aufgenommen. Und wo Nährstoffe in großer Zahl vorhanden sind, finden sich auch Mikroorganismen. Getrennt wird der Wirtsorganismus vor diesen durch eine Barriere, die nur aus einer Zellschicht besteht. Es ist daher verständlich, dass das Immunsystem in der Lage sein muss, schnell und effektiv starke Immunantworten gegen Krankheitserreger zu generieren. Nichtsdestotrotz besteht das Gros des Darminhaltes aus Bestandteilen der Nahrung und aus der harmlosen „Tischgemeinschaft“, der kommensalen mikrobiellen Flora, die beide toleriert werden müssen. Andernfalls droht eine Nahrungsmittelallergie oder eine chronische Darmentzündung. Da Toleranz gegen harmlose Antigene im Darm so wichtig ist, wird dort die Foxp3-Expression in denjenigen T-Zellen angeregt, die aus dem Thymus stammen und harmlose Antigene erkennen. Dadurch entstehen regulatorische T-Zellen, die gezielt eine Immunreaktion gegen den Darminhalt vermeiden.
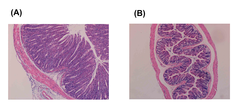
Experimente mit genetisch identischen Mäusen zeigten, dass jedes Individuum T-Zellen enthält, die potenziell auf die Darmflora reagieren und eine tödliche Darmentzündung auslösen können. Bei den Experimenten wurden T-Zellen, die ihrem Antigen noch nie begegnet waren (naive T-Zellen), aus einer gesunden Maus entnommen und in eine immundefiziente Maus injiziert. Diese T-Zellen reagierten gegen die normale Darmflora und lösten eine chronische Entzündung aus. Interessanterweise kann dieser Effekt unterbunden werden, wenn den Mäusen gleichzeitig regulatorische T-Zellen injiziert werden (Abb. 1). Dies zeigt die Bedeutung dieses immunregulatorischen Zelltyps für das Immungleichgewicht im Darm. Dass die menschlichen regulatorischen T-Zellen eine ähnlich wichtige Aufgabe im Darm erfüllen, ergaben Untersuchungen an Patienten mit Mutationen in FOXP3, die meistens unter Darmentzündung leiden.
Forschungen zur Immuntoleranz am MPI für Immunbiologie und Epigenetik
Die Biologie der regulatorischen T-Zellen wird noch nicht vollständig verstanden. Die Gruppe um Ana Izcue hofft, die offenen Fragen zum Teil aufklären zu können. Ein Schwerpunkt der Arbeiten ist die Kommunikation zwischen Darmepithelzellen und dem Immunsystem, die zur Toleranz führt. Darmepithelzellen stellen die Grenze des Körpers zur „Außenwelt“ dar. Aber die Funktionen der Darmepithelzellen reichen weit über die eines einfachen Schutzwalls hinaus. Sie haben Rezeptoren, die Bakterien- und Viren-spezifische Strukturen erkennen und den Darminhalt somit kontinuierlich kontrollieren können. Außerdem produziert das Darmepithelium Rezeptoren, die von Zellen des Immunsystems erkannt werden können. Ein prominentes Beispiel ist der MHCII-Komplex, der die Antigenerkennung der T-Zellrezeptoren vermittelt. Des Weiteren können Darmepithelzellen Immunzellen durch lösliche Signalmoleküle, wie z.B. Interleukine und Chemokine, rekrutieren und aktivieren.
Um die Wechselwirkung zwischen Epithel- und Immunzellen und die Bildung der Immuntoleranz besser zu verstehen, werden im Max-Planck-Institut für Immunbiologie und Epigenetik unter anderem genetisch modifizierte Mausstämme benutzt, denen eine einzige Komponente der interzellulären Kommunikationskaskade fehlt. Außerdem arbeiten die Wissenschaftler mit Mausmodellen, in denen Mäuse T-Zellen produzieren, die alle dasselbe Antigen erkennen. Mit diesen Mäusen kann man die Entstehung der regulatorischen T-Zellen zur Nahrungsmittelerkennung im Darm studieren. Diese im Darm entstandenen regulatorischen T-Zellen können auch Entzündungen vermeiden [4].

Die Entstehung der Darmentzündung bei verminderter Toleranz wird von der anwesenden (kommensalen) Mikroflora stark beeinflusst (Abb. 2). Die Rolle der kommensalen Flora bei Darmimmuntoleranz ergibt sich aus Studien, in denen die Immunantwort bei keimfreien Organismen analysiert wird. Die Relevanz der Befunde für Patienten kann nachfolgend durch klinische Partner im Centrum für Chronische Immundefizienz des Universitätsklinikums Freiburg evaluiert werden.
Regulatorische T-Zellen haben ein hohes therapeutisches Potenzial, da sie nicht nur helfen, Entzündungen zu vermeiden, sondern auch bestehende inflammatorische Prozesse eindämmen können [5]. Durch Manipulation regulatorischer T-Zellen könnten sich zum Beispiel neue Behandlungsmethoden für Autoimmunerkrankungen oder chronische Darmentzündungen ergeben; ein weiteres wichtiges Anwendungsgebiet könnte die Transplantationsmedizin sein. Bei der Fülle von positiven Eigenschaften darf man potenziell schädliche Eigenschaften der regulatorischen Zellen nicht aus den Augen verlieren. Bei mehreren Krebsarten wurde der schädigende Effekt von regulatorischen T-Zellen nachgewiesen. Hier rekrutiert der Tumor eben jene Zellen und induziert dadurch ein immunsuppressives Milieu, um einer für den Organismus positiven Immunantwort zu entgehen. Um regulatorische T-Zellen im therapeutischen Bereich einsetzen zu können, muss daher erst genau verstanden werden, wie sie entstehen, wie sie arbeiten und wie sie kontrolliert werden.

