Im Rampenlicht: Zellen der angeborenen Immunantwort erstrahlen in Freiburg
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für Immunbiologie und Epigenetik
Ein Verbund aus Wächter- und Fresszellen als angeborener Immunschutz
In unserem täglichen Leben begegnen wir einer Vielfalt von Bakterien, Viren, Pilzen und anderen Mikroorganismen. Weil uns einige davon schädlich werden können, hat der menschliche Körper zu seinem Schutz eine mehrschichtige Immunabwehr entwickelt. Als erste Verteidigungslinie verhindern natürliche Körperbarrieren, zum Beispiel die Haut und Schleimhäute, ein einfaches Eindringen von Erregern in unseren Körper. Werden diese Barrieren durchbrochen, beispielsweise durch Verletzungen, versuchen Zellen der angeborenen Immunabwehr, krankheitserregende Eindringlinge abzufangen und diese zu eliminieren. Dabei kooperieren mehrere Zelltypen, die sich durch unterschiedliche Fähigkeiten auszeichnen, gemeinsam das Gewebe zu schützen (Abb. 1).

Um Erreger schnell in unserem Körper aufzuspüren, sind bereits mehrere Arten von Wächter- und Fresszellen - Makrophagen, Dendritische Zellen, Mastzellen - in den Geweben unserer Organe verteilt. Weitere Typen von Fresszellen - neutrophile Granulozyten und Monozyten - zirkulieren ständig durch die Blutgefäße und patrouillieren durch unseren gesamten Körper. Sie verlassen die Gefäße nur, wenn im Laufe einer Entzündung oder Infektion die gewebsständigen Zellen nach ihrer Hilfe und Unterstützung rufen. Die Prozesse der angeborenen Immunantwort sind schnell und richten sich unspezifisch gegen Mikroorganismen aller Art. Ziel dabei ist es, binnen Stunden eine mögliche Verbreitung von schädlichen Erregern zu unterbinden. Gleichzeitig stößt das angeborene Immunsystem die Reaktionen des adaptiven Immunsystems - T und B Lymphozyten - an, die dann über den Zeitraum von mehreren Tagen eine spezifische Immunantwort auf einen einzelnen Erreger anpassen.
Auf der Basis jahrzehntelanger Forschung sind mittlerweile die verschiedenen Typen von Immunzellen und deren spezielle Funktionen gut charakterisiert. Ebenso sind viele der immunaktivierenden Substanzen und Signalstoffe des angeborenen Immunsystems bekannt. Allerdings versteht man bisher nur bedingt, wie diese zusammenspielen, um das Verhalten von verschiedenen Zelltypen in der Komplexität eines entzündeten Gewebes zu koordinieren. Untersucht werden daher jetzt diejenigen Voraussetzungen, die Immunzellen benötigen, damit sie sich in entzündeten und infizierten Geweben orientieren und fortbewegen können. Des Weiteren studieren die Wissenschaftlerinnen und Wissenschaftler, wie einzelne Immunzellen miteinander kommunizieren, um zusammen eine optimale Immunantwort zu gewährleisten. Die Forscher nutzen dazu eine spezielle Methode, die sogenannte Zwei-Photonen-Mikroskopie, die es erlaubt, das Verhalten von Immunzellen am Ort einer realen Entzündung oder Infektion in Echtzeit zu beobachten. Basierend auf diesen Erkenntnissen werden Methoden entwickelt, um das komplexe Milieu einer Entzündung und dessen Einfluss auf die Dynamiken von Immunzellen in der Zellkulturschale nachzustellen. Aus den daraus resultierenden Ergebnissen erhoffen die Wissenschaftler die Identifizierung von Molekülen, die das Verhalten von angeborenen Immunzellen regulieren, was wiederum die Erkennung potenzieller therapeutischer Angriffspunkte für die Beeinflussung von entzündlichen Zuständen, Infektionen und überschießenden Immunreaktionen mit sich ziehen wird.
Neutrophile Granulozyten bekämpfen Eindringlinge im Schwarm
Einer der Forschungsschwerpunkte im Labor liegt auf der Betrachtung des Wanderungsverhaltens neutrophiler Granulozyten, kurz Neutrophile genannt, einer speziellen Art von Fresszellen, die besonders für die Bekämpfung von Bakterien und Pilzen wichtig sind. Neutrophile werden im Knochenmark gebildet und mit dem Blutstrom im Körper verteilt. Am Ort einer lokalen Entzündung oder Infektion treten sie aus den Gefäßen und gehen dann im Gewebe auf die Jagd nach möglichen Erregern. Dort finden sich große Schwärme dieser Fresszellen zusammen, die gemeinsam die Eindringlinge bekämpfen ([1]; Abb. 2).
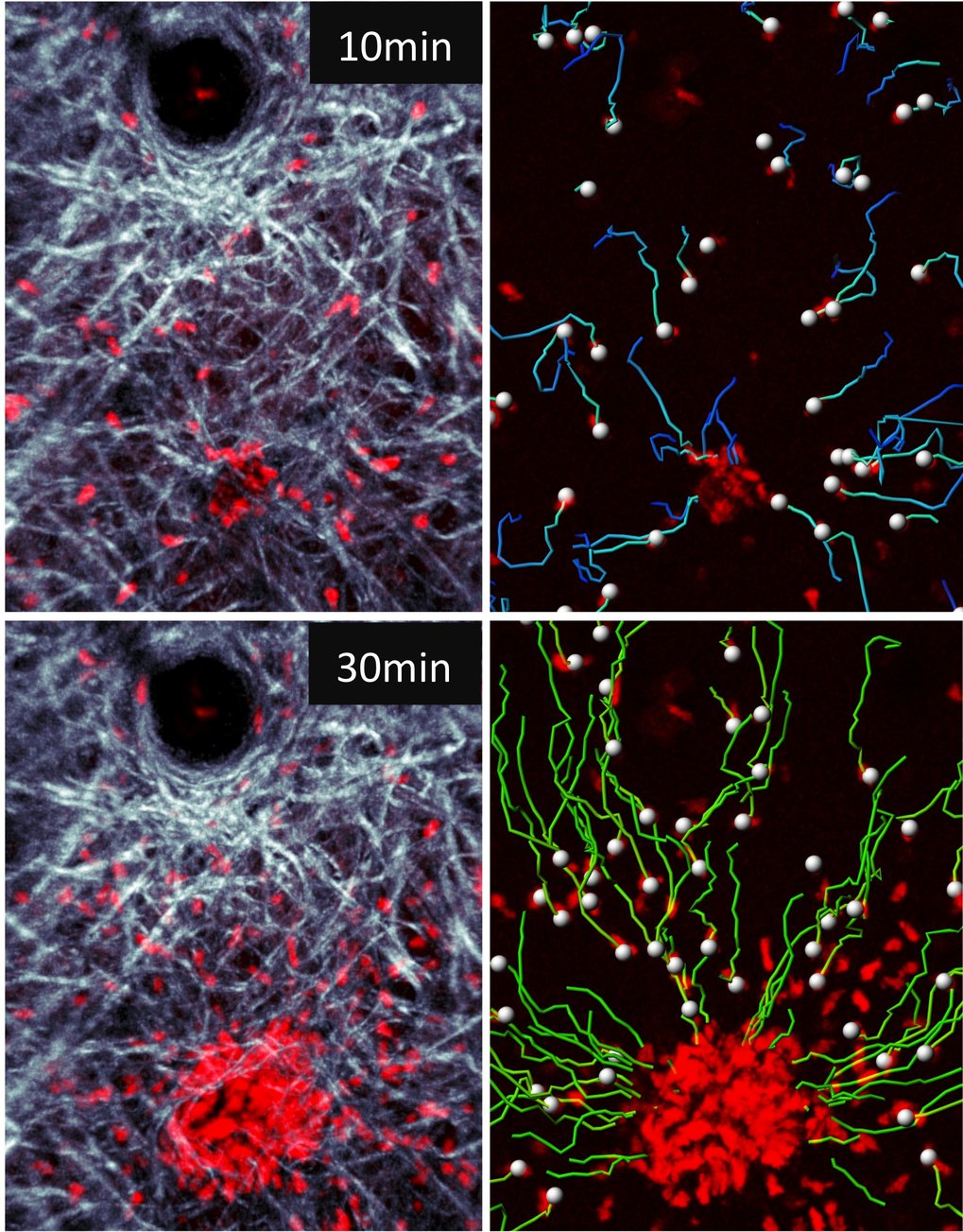
Wie sich Neutrophile im Gewebe orientieren und diese imposanten Zell-Schwärme bilden, war lange Zeit unbekannt. Mittels Zwei-Photonen-Mikroskopie gelang es Wissenschaftlern des Lämmermann-Labors in Zusammenarbeit mit Kollegen aus den National Institutes of Health (USA), die molekularen Grundlagen dieses Schwarmverhaltens zu entschlüsseln. Nach diesen Ergebnissen sind mehrere verschiedene Moleküle an der Zusammenballung zu einem Schwarm beteiligt [2]. Eine Schlüsselrolle kommt hierbei dem Lipid Leukotrien B4, kurz LTB4, zu. Bei LTB4 handelt es sich um einen Botenstoff, der Entzündungsreaktionen des Körpers einleitet und aufrechterhält. Wie die Forscher beweisen konnten, schütten Neutrophile selbst das LTB4 aus, das wiederum von weiteren Neutrophilen erkannt wird und ihnen das Signal gibt, sich dem Schwarm anzuschließen. Damit wiesen die Forscher erstmals nach, dass Neutrophile in der Tat miteinander kommunizieren können.
Neutrophile besitzen in ihrem Zellinneren Substanzen, die für Mikroorganismen schädigend sind und sie töten können. Die Wissenschaftler vermuten, dass die Zusammenballung zu einem Schwarm wahrscheinlich eine sehr hohe lokale Konzentration der antimikrobiellen Wirkstoffe ermöglicht und somit der Verbreitung von Erregern erfolgreich entgegenwirkt. Kommt es jedoch zu einer unkontrollierten Ausschüttung dieser sehr reaktiven Substanzen, so kann auch das umliegende Gewebe einen Schaden davon tragen. Solch überschießende Antworten von Neutrophilen können am Ende negative Folgen für einen Organismus haben und einen Nährboden für chronische Entzündungen oder nicht-heilende Wunden bieten. In weiteren Arbeiten wollen die Wissenschaftlerinnen und Wissenschaftler nun herausfinden, wie genau sich die Neutrophilen-Schwärme wieder auflösen und nachfolgend sich die Entzündungsstelle regeneriert. Von ihren Arbeiten erhoffen sich die Forscher neue grundlegende Erkenntnisse über diejenigen molekularen Prozesse der angeborenen Immunantwort, die eine optimale Balance zwischen Schutz vor Erregern und unerwünschten Gewebeschäden gewährleisten.