Einheit für transgene Mäuse
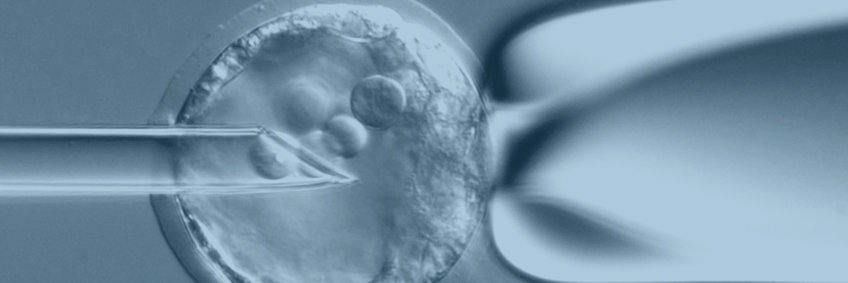
Die Transgenic Mouse Core Facility (TMCF) ist bestrebt, qualitativ hochwertige, hochmoderne transgene und assistierte Reproduktionstechnologien zeit- und kosteneffizient anzubieten. Wir stellen Forschern neuartige Mauslinien zur Verfügung, die entweder durch Transgenese (durch Pronuklear/Zytoplasmatische Mikroinjektion spezifischer DNA-Konstrukte in befruchtete Eizellen) oder gezielte Mutagenese (durch Mikroinjektion embryonaler Stammzellen (ES-Zellen) in Blastozysten oder 8-zellige Embryonen im Stadium sowie durch verschiedene CRISPR/Cas9-Ansätze) erzeugt werden, z.B. "Knockouts", bedingte Mutanten oder geneduzierte Tiere. Zu den Techniken der assistierten Reproduktion gehören die Kryokonservierung von Embryonen und Spermien, IVF und der genetisch manipulierte Embryotransfer.
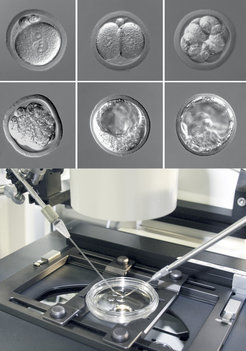
Wir treiben die epigenetische Forschung voran, indem wir die Rolle spezifischer Gene während der Präimplantation oder der späteren Embryonalentwicklung entschlüsseln. Und wir unterstützen spezifische Forschungsprojekte, indem wir z.B. ES-Morula-Aggregationen, mRNA- oder siRNA-Injektionen/Elektroporation und anschließende Immunfluoreszenz-Analysen durchführen.
Unsere barrieregestützte transgene Forschungseinrichtung gewährleistet einen spezifischen pathogenfreien (SPF) Gesundheitsstatus und beherbergt gentechnisch veränderte Mäuse in individuell belüfteten Käfigsystemen (IVC), die von speziell geschultem und qualifiziertem Tierpflegepersonal betreut werden. Embryonen (z.B. mikromanipuliert, zur Revitalisierung oder aus importierten Mauslinien) werden unter strengen sterilen Bedingungen in pseudoschwangere Pflegemütter in diesen Barrierebereich übertragen. Serologieuntersuchungen an ausgewählten Tieren werden systematisch durchgeführt, um ihren Gesundheitszustand zu dokumentieren. Erst nach der Identifizierung von Keimbahn-Transmittern sind die Forschenden für die Züchtung und Analyse ihrer Mauslinien unter strikter Einhaltung des deutschen Rechts verantwortlich sein.
Wir unterstützen und fördern die 3R-Grundsätze innerhalb unserer Experimente, indem wir uns bemühen, neue Technologien zu entwickeln und umzusetzen, wie z.B.: neue Wege, um möglichst präzise und gezielte Veränderungen am Genom vorzunehmen, durch die Nutzung des CRISPR/Cas9-Techniken, durch die Steigerung der Effizienz der verschiedenen Methoden assistierten Reproduktion sowie durch die Minimierung von Schmerzen, indem wir die Injektionsanästhesie durch Inhalationsanästhesie ersetzen.
Wir freuen uns über jede Gelegenheit, Design, Wissen und Expertise zu fördern, um die Forschungsziele der Forscher zu erreichen.
Weitere Informationen zu den Services der Einheit für transgene Mäuse finden Sie auf der englischen Seite.
