Wie sich Schwärme von Immunzellen selbst organisieren
Forschungsbericht (importiert) 2021 - Max-Planck-Institut für Immunbiologie und Epigenetik
Immunologische Erstabwehr von Infektionserregern
Unsere Körper sind durch Barrieren wie die Haut gut vor eindringenden Krankheitserregern geschützt. Durch Verletzungen, wie etwa bei einem Riss in der Haut, können jedoch Krankheitserreger durch die Wunde in den Körper eindringen und schwere Infektionen verursachen. Wenn dies geschieht, übernimmt das angeborene Immunsystem die erste Verteidigungslinie mit einem effektiven Arsenal an zellulären Waffen. Als einer der ersten Zelltypen vor Ort werden neutrophile Granulozyten, auch kurz Neutrophile genannt, innerhalb weniger Stunden aus dem Blutkreislauf in das verletzte Gewebe rekrutiert, um möglichst schnell mikrobielle Eindringlinge aufzunehmen und zu zerstören.
Schwärme von Fresszellen als angeborener Immunschutz
Neutrophile sind unscheinbar wirkende, runde Immunzellen mit einem Durchmesser von ca. 0,015 Millimetern, die im menschlichen Blut etwa 50-70% der weißen Blutkörperchen ausmachen. Nur an den Orten einer lokalen Entzündung oder Infektion treten sie aus den Blutgefäßen heraus, werden aktiviert und gehen dann im dortigen Gewebe auf die Jagd nach Erregern. Auf diese Weise patrouillieren diese Zellen fast alle Bereiche unseres Körpers.
Mittels einer Vielzahl an Rezeptoren auf ihrer Zelloberfläche sind Neutrophile besonders darauf spezialisiert, die Alarmsignale von Zellen zu erkennen, die durch Verletzungen oder eindringende Mikroben geschädigt wurden. Sobald einzelne Neutrophile solche Signale erkennen, rufen sie mittels chemischer Botenstoffe weitere Neutrophile zu Hilfe. Im Zuge unserer Forschung ist es uns gelungen, die Schlüsselrolle des Lipids Leukotrien B4, kurz LTB4, für genau diese Kommunikation zwischen den Immunzellen aufzudecken (Abb. 1; [1]). Dieses Lipid wird von den Neutrophilen ausgeschüttet, um die Richtung vorzugeben, der die anderen Neutrophile folgen sollen. Durch diese interzelluläre Kommunikation bilden Neutrophile imposante Zellschwärme, die zum Teil mehrere Hundert Zellen umfassen können, wodurch sie als Zellkollektiv gemeinsam im Gewebe agieren.
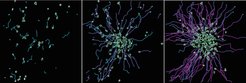
Neben ihrer besonderen Effektivität beim Jagen von Bakterien sind Neutrophile auch noch hervorragend ausgerüstet, um diese zu töten und aus dem Gewebe zu entfernen. Hierzu besitzen sie in ihrem Zellinneren mehrere antibakterielle Substanzen, die Krankheitserreger töten können. Gelangen diese Substanzen jedoch aus der Zelle in ihre Umgebung, dann können sie schädlich für die umliegenden Gewebestrukturen aus Eiweißen und Zuckern sein. Ein Überschießen der nützlichen Entzündungsreaktion kann auf diese Weise zu massiven Gewebeschäden führen und zur Gefahr für den Körper werden. Ein solches Ungleichgewicht liegt häufig bei hyperinflammatorischen Reaktionen vor und wird aktuell auch als eine der Ursachen für Lungenschäden in schweren Fällen von Covid-19 Erkrankungen diskutiert [2].
Eine molekulare Bremse, um den Schwarm zu stoppen
Am Max-Planck-Institut für Immunbiologie und Epigenetik haben wir uns deshalb der Frage gewidmet, auf welche Weise das Schwarmverhalten von Neutrophilen zum Erliegen kommt, um eine unkontrollierte Anhäufung dieser Zellen im Gewebe zu vermeiden und so eine übermäßige Entzündung zu verhindern. Während in den letzten Jahren immer mehr Erkenntnisse zu den auslösenden Mechanismen von Neutrophilen-Schwärmen gewonnen wurden, blieben diejenigen Prozesse unbekannt, die diesen Teil der Immunreaktion wieder beenden.
In unseren Studien konnten wir aufklären, dass Neutrophile ihre Schwarmaktivität selbst begrenzen und somit eine optimale Balance zwischen Such- und Zerstörungsphasen bei der Beseitigung von Erregern ermöglichen [3]. Diese Erkenntnisse waren überraschend, denn bisherige Annahmen gingen von externen Signalen aus der Gewebeumgebung aus, die die Neutrophilen-Aktivität während der Auflösungsphase einer Entzündung dämpfen. Durch den Einsatz spezieller Mikroskope für die Echtzeit-Visualisierung der Immunzelldynamik in lebendem Mausgewebe konnten wir jedoch zeigen, dass schwärmende Neutrophile über die Zeit unempfindlich gegenüber ihren eigenen Signalen werden, mit denen sie den Schwarm ursprünglich initiiert haben. Um dies zu bewerkstelligen, besitzen Neutrophile eine molekulare Bremse, mit der sie ihre Bewegung stoppen, sobald sie hohe Konzentrationen der sich anhäufenden Schwarmlockstoffe in den Neutrophilen-Clustern wahrnehmen.
Jagdstrategien der Fresszellen
Das die Bremswirkung vermittelnde Protein trägt den Namen „G-Protein gekoppelte Rezeptor Kinase 2 (GRK2)“, die dafür sorgt, dass bei hohen Konzentrationen an Schwarmlockstoffen die Zellen nicht mehr auf diese Signale reagieren und somit stehen bleiben. Angesichts der Entdeckung des Start-Stopp-Systems in Neutrophilen lag es nahe, zeitgleich geläufige Hypothesen zu Bewegungsmustern und Jagdstrategien von Fresszellen zu überprüfen. In Experimenten mit Neutrophilen, denen der Start-Stopp-Mechanismus fehlte, beobachteten wir, dass sich diese Zellen viel schneller im Gewebe bewegten und somit in großen Gewebebereichen nach Bakterien Ausschau halten konnten. Die Neutrophilen selbst hatten jedoch keinen Vorteil davon, sich besonders schnell im Gewebe bewegen zu können und ungebremst umherzueilen. Im Gegenteil: Neutrophile agieren viel effektiver, wenn sie als Schwarm eine infizierte Zelle eingrenzen und dann dort verharren. Auf diese Weise bilden sie nämlich eine zelluläre Barriere, welche das Wachstum und die weitere Verbreitung von Bakterien lokal eindämmt.
Unsere Ergebnisse haben einen wichtigen Aspekt der Biologie von Neutrophilen entschlüsselt, der vor allem für die Immunabwehr gegen Bakterien von besonderer Bedeutung ist. Unsere unerwarteten Erkenntnisse zu den Jagdstrategien der Immunzellen können wichtige Impulse vor allem für neue therapeutische Ansätze darstellen. Darüber hinaus könnten die hier beschriebenen Mechanismen zum Schwarmverhalten der Neutrophilen auch die Forschungen zum kollektivem Verhalten von Zellverbänden bis hin zum kollektiven Verhalten einiger Insektenarten bereichern.
