Lockstoffe für das Kollektiv
Der Max-Planck-Wissenschaftler Tim Lämmermann erforscht, wie Immunzellen in Schwärmen auf die Jagd nach Krankheitserregern gehen. Die Zellen zeigen dabei ein Verhalten, das Biologen auch von einem Insekt kennen: der Asiatischen Honigbiene
Der Max-Planck-Wissenschaftler Tim Lämmermann erforscht, wie Immunzellen in Schwärmen auf die Jagd nach Krankheitserregern gehen. Die Zellen zeigen dabei ein Verhalten, das Biologen auch von einem Insekt kennen: der Asiatischen Honigbiene.
Text: Tim Lämmermann & Harald Rösch
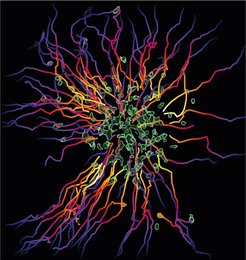
Im Kampf Frau gegen Frau hat die Asiatische Honigbiene gegen eine Hornisse keine Chance. Trotzdem kann sich die Biene gegen den Eindringling behaupten – wenn sie ihre Schwestern zu Hilfe ruft: Verletzt eine angreifende Hornisse eine Biene, werden Pheromone freigesetzt, die andere Arbeiterinnen des Stocks alarmieren. Diese eilen daraufhin in großer Zahl herbei und bilden mit ihren Leibern eine undurchdringliche Kugel um die Hornisse. Im Innern des Balls steigt die Temperatur so stark an, dass die Hornisse buchstäblich „gekocht“ wird und an Überhitzung stirbt.
Wenn auch Zellen des Immunsystems auf den ersten Blick mit Bienen wenig gemeinsam haben, im Verteidigungsfall verhalten sie sich ganz ähnlich. Insbesondere Zellen der angeborenen Immunantwort wenden dieselbe Taktik an, wenn sie auf Krankheitserreger treffen. Geleitet von verschiedenen Alarm- und Botenstoffen strömen sie aus allen Richtungen zu den Eindringlingen. Anders als die Bienen töten diese Zellen Eindringlinge jedoch nicht durch Überhitzung, sie schirmen die Erreger vielmehr vom umliegenden gesunden Gewebe ab und machen sie mithilfe ihrer chemischen Waffen unschädlich. „Es ist eine faszinierende Erkenntnis, dass das Schwarmverhalten von Immunzellen und Insekten zum Teil ähnlichen Regeln folgt – obwohl sie doch ganz unterschiedliche Einheiten des Lebens sind“, sagt Tim Lämmermann.
Jäger und Wächter des Immunsystems
Lämmermann und sein Team konzentrieren sich am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg auf sogenannte neutrophile Granulozyten. Die auch einfach als „Neutrophile“ bezeichneten Immunzellen werden im Knochenmark gebildet und patrouillieren im Blut durch den ganzen Körper. Sie bilden als Wächter und Jäger einen wichtigen Bestandteil des angeborenen Immunsystems und sind mit die Ersten am Ort einer Entzündung oder Infektion. Dank ihrer flexiblen Form bewegen sie sich wie eine Amöbe vorwärts und schlüpfen so durch die Wände von Blutgefäßen und selbst dichtes Gewebe. Mithilfe molekularer Sensoren auf ihrer Oberfläche erkennen die Neutrophilen Alarmsignale verletzter oder geschädigter Zellen. Eindringlinge wie Bakterien, Parasiten und Pilze werden mithilfe antimikrobieller Substanzen abgetötet.

Vor fünfzehn Jahren beobachteten Forschende mittels spezieller Mikroskopie in verschiedenen Organen von Mäusen ein bemerkenswertes Verhalten der Neutrophilen: Sobald die Wissenschaftler eine Entzündung hervorriefen oder Krankheitserreger das Gewebe infizierten, strömten diese Immunzellen aus allen Richtungen zusammen. Sie verhielten sich dabei wie ein Schwarm und griffen die Erreger koordiniert an. „Es war damals schon offensichtlich, dass sich die Zellen untereinander koordinieren, auch wenn noch nicht bekannt war, wie sie das tun“, so Lämmermann.
Zu schwärmenden Immunzellen kam Lämmermann über Umwege. Zunächst konzentrierte sich der Wissenschaftler, der nach seiner Promotion an den National Institutes of Health in den USA forschte, auf Makrophagen. Auch diese Zellen der angeborenen Immunantwort machen Jagd auf Krankheitserreger und beseitigen diese. „Es stellte sich rasch heraus, dass Makrophagen 20- bis 100-mal langsamer sind als Neutrophile. Das machte die Experimente zeitaufwendig und mühsam. Bei dem Schneckentempo der Makrophagen wäre mein Visum abgelaufen, bevor ich die ersten Ergebnisse aufzuweisen gehabt hätte“, erzählt Lämmermann mit einem Augenzwinkern. Beim Blick durchs Mikroskop fiel dem Forscher aber noch etwas auf: Neben den lahmen Makrophagen huschten immer auch Neutrophile durchs Bild. „Im Vergleich zu den trägen Makrophagen war das ein regelrechtes Gewusel. Daraufhin habe ich kurzerhand auf die Neutrophilen umgesattelt – eine Entscheidung, die sich als goldrichtig herausgestellt hat.“ Fasziniert von diesem Verhalten verschrieb sich Lämmermann fortan der Erforschung des Schwarmverhaltens dieser Immunzellen. Seitdem haben er und sein Team wichtige Erkenntnisse darüber gewonnen, wie sich die Zellen zu einem Schwarm zusammenfinden und diesen wieder auflösen können. Letzteres ist entscheidend dafür, dass die Immunreaktion nicht übers Ziel hinausschießt.
Zusammen mit Forschenden anderer Institutionen hat Lämmermann verschiedene Etappen der Schwarmbildung identifiziert: Kurz nach einer Verletzung verändern einige wenige Neutrophile in unmittelbarer Umgebung ihr Bewegungsmuster und wandern gezielt zum Ort der Entzündungsreaktion. Auf diese erste folgt eine zweite Welle von Zellen aus entfernteren Körperregionen. Angezogen werden die Neutrophilen durch einen Mix an Substanzen, die von geschädigten oder sterbenden Zellen abgegeben werden und die sie mithilfe von rund 30 Rezeptoren auf der Zelloberfläche wahrnehmen. Die Forschenden haben entdeckt, dass oft schon eine einzige sterbende Zelle ausreicht, um die Neutrophilen herbeizurufen. Welche Alarmstoffe von der Stelle des Gewebeschadens oder den toten Zellen die Neutrophilen in dieser frühen Phase anlocken, ist jedoch noch nicht im Detail verstanden.

Damit sich die Neutrophilen im weiteren Verlauf zu einem Schwarm zusammenfinden können, ist nach Lämmermanns Erkenntnissen ein Botenstoff unerlässlich: das Leukotrien B4, kurz LTB4. Aktivierte Neutrophile geben diese Substanz nach außen ab, nehmen sie aber auch dank spezieller Rezeptoren selbst wahr. Dabei registrieren sie Änderungen der LTB4-Konzentration in der Umgebung und wandern in die Richtung zunehmender Konzentrationen. Mehr Neutrophile schütten mehr Leukotrien B4 aus, dadurch werden noch mehr Zellen angezogen. Auf diese Weise bilden Neutrophile imposante Schwärme, in denen sich zum Teil mehrere Hundert Zellen an einer geschädigten Stelle im Gewebe zusammenfinden. „Neutrophile sind also keine kompletten Einzelgänger. Sie kommunizieren miteinander, wenn sie einen Schwarm bilden, und agieren somit als Kollektiv“, erklärt Lämmermann. Am Ort der Entzündung „krallen“ sich die Neutrophilen dann förmlich aneinander und bilden einen undurchdringlichen Haufen. Auf diese Weise schirmen sie den Entzündungsherd von der Umgebung ab und können dadurch verhindern, dass sich Bakterien, Pilze und Parasiten im Körper ausbreiten. Gegen die derart umzingelten Erreger können sie nun effektiv vorgehen.
Immer den Lockstoffen nach
Neben LTB4 produzieren Neutrophile auch den Botenstoff CXCL2. Auch diese zu den Chemokinen gehörende Substanz wirkt schwarmbildend für diese Zellen. Die Lockstoffe LTB4 und CXCL2 sowie die von einer Entzündungsreaktion ausgeschütteten Alarmstoffe gehören also zu den zentralen Elementen, die den Schwarm zusammenhalten. „Ein Schwarm Neutrophile folgt einem simplen positiven Rückkopplungsprinzip“, sagt Lämmermann: „Die einzelnen Zellen bewegen sich in Richtung steigender Lockstoffkonzentration. Auf diese Weise kann schon eine kleine Gruppe immer weitere Zellen anziehen und nach und nach zum Schwarm werden.“ Wenn es an mehreren Stellen im Gewebe „brennt“, dann bilden sich mehrere benachbarte Schwärme, die zum Teil um Mitglieder konkurrieren. Die größeren sind dabei im Vorteil und schlucken einfach die kleineren Kollektive.
„Die Neutrophilen brauchen folglich keine zentrale lenkende Instanz, sie bilden vielmehr ein sich selbst organisierendes System. In vielerlei Hinsicht ähneln die Neutrophilen-Kollektive durchaus den Schwärmen bestimmter Insektenarten oder auch dem Gruppenverhalten von Schleimpilzen“, sagt Lämmermann. „Unseren Erkenntnissen zufolge halten einzelne Neutrophile jedoch nicht wie Fische und Vögel im Schwarm den Abstand zu ihren Nachbarn ein“, fügt der Wissenschaftler hinzu. Nach einer gewissen Zeit lösen sich die Neutrophilen-Schwärme wieder auf. Dies soll verhindern, dass die Zellen Schaden anrichten, wenn sie in ihrer lokalen Ansammlung etwa Gerüstproteine zerstören und regelrecht Löcher ins Gewebe „fressen“. Eine übers Ziel hinausschießende Immunreaktion wird oftmals bei starken Entzündungen beobachtet und könnte eine der Ursachen für Lungenschäden bei schweren Verläufen von Covid-19 sein. Der Körper muss also die Aktivität der Neutrophilen sehr sorgfältig austarieren.
Tim Lämmermann und sein Team haben sich deshalb in den letzten Jahren verstärkt mit der Frage beschäftigt, was das Wachstum eines Neutrophilen-Schwarms eigentlich beendet. Die Ergebnisse der Forschenden zeigen, dass die Zellen auch dieses Verhalten selbst steuern können und somit eine optimale Balance zwischen den Such- und Zerstörungsphasen im Kampf gegen Krankheitserreger herstellen. „Wir haben beobachtet, dass schwärmende Neutrophile mit der Zeit unempfindlich gegenüber ihren eigenen Lockstoffen wie dem Leukotrien B4 werden – also gegenüber jenen Signalen, mit denen sie den Schwarm ursprünglich initiiert haben“, erklärt Lämmermann.
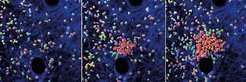
Dieser Befund kam überraschend, denn zuvor hatte man angenommen, Botenstoffe und Signale von anderen Zelltypen im Gewebe würden die Neutrophilen wieder inaktivieren und den Schwarm auflösen. Stattdessen besitzen die neutrophilen Fresszellen eine molekulare Bremse, mit der sie selbst ihre Bewegung stoppen, sobald sie sehr hohe Konzentrationen der sich anhäufenden Lockstoffe wahrnehmen. Die Bremse hört auf den Namen „G-Protein-gekoppelte Rezeptorkinase 2“ – ein Protein, das dafür sorgt, dass die Zellen bei hohen Konzentrationen nicht mehr auf den Lockstoff reagieren. „Dieses Protein bewirkt, dass die von den Rezeptoren an der Zelloberfläche wahrgenommenen Lockstoffsignale ab einem gewissen Punkt nicht mehr ins Zellinnere weitergeleitet werden“, erklärt Lämmermann. Neutrophile ohne diese Bremse reagieren somit ständig auf die Lockstoffe, eilen unablässig im Gewebe umher und suchen dadurch ein viel zu großes Gebiet nach Entzündungen ab. Die meist punktuell wachsenden Krankheitserreger können sie so nicht wirksam bekämpfen. „Anstatt rastlos herumzusuchen, ist es viel effektiver, im Schwarm einen Infektionsherd einzukreisen und abzuschotten“, so Lämmermann.
Die Forschenden haben damit einen wichtigen Aspekt der Immunabwehr gegen Bakterien aufgedeckt. Ihre Erkenntnisse liefern wichtige Impulse für die Erforschung des Kollektivverhaltens anderer Zellverbände bis hin zum Schwarmverhalten höherer Organismen. „Das Verhalten der Neutrophilen erinnert tatsächlich an die Reaktion der Asiatischen Honigbienen auf einen Hornissenangriff. Auch diese Bienen verhalten sich schwarmartig, sobald sie die Substanzen riechen, die von einer verletzten Artgenossin abgegeben werden“, sagt Lämmermann. Pheromone der Arbeiterinnen alarmieren weitere Tiere, die dann der steigenden Pheromonkonzentration folgen und den Eindringling umzingeln. Die „Hitzekugel“ der Bienen ähnelt dabei den Ansammlungen von Neutrophilen, die das antibakterielle Arsenal vieler einzelner Zellen an einem Ort zusammenbringen. Und wie die Immunzellen brauchen auch die Bienen keine Anführerin: Sie riechen, was zu tun ist, und organisieren sich dann einfach selbst.
Auf den Punkt gebracht
Manche Immunzellen bilden auf der Jagd nach Krankheitserregern Schwärme aus mehreren Hundert Zellen. Die Zellen geben dabei Substanzen ab, die weitere Zellen anlocken.
Die Zellschwärme sind sich selbst organisierende Systeme, die einem positiven Rückkopplungsprinzip folgen: je höher die Konzentration des Lockstoffs, desto stärker die Anziehung.
Mit der Zeit sinkt die Empfindlichkeit der Immunzellen für ihren eigenen Lockstoff. Auf diese Weise kann sich der Schwarm wieder auflösen, sobald die Immunreaktion beendet ist.



