Nachtschicht in der Mitose
Freiburger Wissenschaftler entdecken eine unerwartete Funktion für epigenetischen Faktor während der Zellteilung.
Proliferierende Zellen durchlaufen während ihres "Lebenszyklus" zwei Stadien: In der Interphase werden Gene aktiv abgelesen und das genetische Material wird verdoppelt. In der Mitose, wenn sich die Mutterzelle teilt, werden die Chromosomen so verteilt oder "getrennt", dass zwei Tochterzellen mit der gleichen Erbinformation entstehen. Für das Überleben der Zelle ist es entscheidend, das beide Prozesse (Genexpression und Chromosomenverteilung) streng kontrolliert werden.
Genaktivität in der Interphase wird von vielen verschiedenen epigenetischen Regulatoren gesteuert. Sie verändern die Struktur des Chromatins (die physiologische Form der DNA) und schalten dadurch Gene an oder aus. Das Akhtar Labor am MPI-IE forscht seit einigen Jahren am NSL-Komplex, einem potenten epigenetischen Regulator, der mehr als 4000 Gene sowohl in Fliegen als auch beim Menschen steuert . "Zum gegenwärtigen Zeitpunkt haben wir ein ziemlich gutes Verständnis davon, wie der NSL-Komplex die Transkription in der Interphase reguliert. Als nächstes wollten wir herausfinden, wie sich der Komplex in anderen Phasen des Zellzyklus verhält", beschreibt Dr. Asifa Akhtar den Startpunkt für ihre neue Studie.
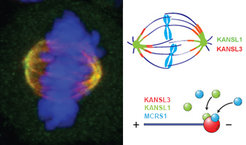
Links: Immunfluoreszenzbild der mitotischen Spindel. Grün - KANSL3; Rot - Tubulin; Gelb - Kolokalisierung von KANSL3 und Tubulin; Blau - DNA
Rechts: Schematische Darstellung der KANSL Proteine an der mitotischen Spindel (oben) oder an Mikrotubuli (unten).
Während der Zellteilung verlassen die meisten epigenetische Regulatoren das Chromatin. Als Maria Shvedunova, Doktorandin und Co-Erstautorin, die Lokalisierung von Komponenten des NSL Komplexes während des Zellzyklus untersuchte, machte sie eine faszinierende Entdeckung: In der Interphase befanden sich die Komponenten des NSL-Komplexes wie erwartet im Zellkern. Zu Beginn der Zellteilung jedoch bewegten sich zwei KANSL Proteine KANSL1, KANSL3) zu den Polen der mitotischen Spindel. Die mitotische Spindel ist das mechanische Gerüst, das an die Chromosomen andockt und sie während der Zellteilung auseinanderzieht. Diese Beobachtung war sehr interessant, da die Forschungsgruppe von Prof. Isabelle Vernos am CRG in Barcelona erst vor kurzem gezeigt hatte, dass MCRS1, eine weitere Komponente des NSL-Komplex, auch an den Spindelpolen sitzt. Diese Ergebnisse deuteten auf eine zusätzliche Rolle der KANSL Proteine bei der Chromosomenverteilung hin. Tatsächlich konnten Zellen, denen auch nur eines der drei Proteine fehlte, sich nicht mehr richtig teilen.
Um die molekularen Mechanismen der KANSL Proteine bei der Zellteilung weiter zu untersuchen, arbeitete das Akhtar Labor mit Prof. Isabelle Vernos und Dr. Sylvain Meunier vom CRG zusammen. Durch elegante Experimente im Reagenzglas konnte das Team nachweisen, dass KANSL Proteine Mikrotubli, die Bausteine der mitotischen Spindel, binden und stabilisieren. Insbesondere KANSL3 zeiget dabei ein interessantes Bindungsverhalten – das Protein erkannte nur das Minus-Ende von Mikrotubuli. "Für das Mikrotubuli-Feld ist dies ein äußerst interessantes Ergebnis. Bisher kennt man nur ein weiteres Protein mit dieser Bindungseigenschaft ", erklärt Maria Shvedunova.
Diese Studie hat den Blick der Forscher auf den NSL-Komplex verändert. "Wir waren überrascht, dass der NSL Komplex zwei unterschiedliche Funktionen während des Zellzyklus ausübt: Er kontrolliert die Expression unserer genetischen Information in der Interphase und stellt die korrekte Verteilung unserer DNA in der Mitose sicher. Diese Erkenntnis hat neue Forschungsperspektiven für mein Labor eröffnet ", sagt Dr. Asifa Akhtar. Die Forscher planen offene mechanistische Fragen zu untersuchen: Wie interagiert KANSL3 mit den Mikrotubuli? Was machen die anderen Komponenten des NSL-Komplexes in der Mitose? Auf lange Sicht könnte ein besseres Verständnis der "Doppelrolle" des NSL-Komplexes sogar einen Einblick in die Ursachen und die zugrundeliegenden Mechanismen von KANSL-assoziierten Erkrankungen wie Krebs oder geistiger Retardierung geben.
