Tumor-Stop
Wie ein kleines Adaptorprotein B-Zell-Tumore stoppt
B-Lymphozyten oder kurz B-Zellen gehören zur Klasse der weißen Blutkörperchen, die wie alle Blutzellen ursprünglich aus dem Knochenmark stammen. Bei Aktivierung werden B-Zellen zu B-Plasmazellen, die dann Antikörper produzieren. Antikörper sind in der Lage während der Immunreaktion, schädliche Pathogene zu erkennen und zu neutralisieren.
Wie alle Zellen des Blutsystems entstehen auch B-Zellen in unserem Knochenmark und entwickeln sich aus Vorläuferzellen (prä-B-Zellen). Während dieser Entwicklung zu ausgereiften B-Zellen durchlaufen sie abwechselnde Phasen des Zellwachstums und der Zellteilung (Proliferation), die unterbrochen sind durch Phasen der Differenzierung, in denen sie sich auf ihre zukünftige Aufgabe als Immunzellen spezialisieren.
Bei dieser Entwicklung handelt es sich um einen sensiblen Prozess. So ist bekannt, dass beispielsweise die akute prä-B-Zell lymphoblastische Leukämie, ein Blutkrebs, der häufig im Kindesalter auftritt, durch ein fehlerhaftes Umschalten zwischen den Phasen der Zellproliferation und Zelldifferenzierung verursacht wird. In diesem Fall verharren unreife Vorläuferzellen in einem frühen Entwicklungsstadium, fahren aber damit fort, sich unkontrolliert zu vermehren. Dabei verdrängt die ungehemmte Teilung der funktionsuntüchtigen Vorläuferzellen die normalen blutbildenden Zellen und führt zu lebensbedrohlichen Tumoren bei den Patienten.
Neue Forschungsergebnisse aus dem Labor von Michael Reth am Max-Planck-Institut für Immunbiologie und Epigenetik, Freiburg (MPI-IE) und der Universität Freiburg haben nun die Rolle eines Proteins aufgedeckt, das als Tumorsuppressor bei derartigen prä-B-Zell Leukämien wirkt. Das Team stellte fest, dass das kleine Protein mit dem Namen B cell translocation gene 2 (BTG2) eine entscheidende Rolle dafür spielt, dass die Vorläuferzellen in ihrer Entwicklung von Phasen der Proliferation in Phasen der Differenzierung umschalten. „Wir haben zeigen können, dass BTG2 in sich differenzierenden prä-B-Zellen stark aktiv ist und auch dass eine induzierte Expression von BTG2 in prä-B-Zellen zu einer sofortigen Unterbrechung der Proliferation führt“, erklärt Dr. Elmar Dolezal, Erstautor der Studie.
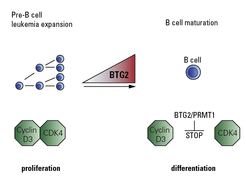
Zudem konnte das Team auch beschreiben, wie genau BTG2 das ungehinderte Wachstum der unreifen Vorläuferzellen stoppt. Es zeigte sich, dass es dafür mit einem weiteren Protein namens Arginin-Methyltransferase 1 (PRMT1) zusammenarbeitet. „Einmal durch BTG2 aktiviert, verhindert das Protein PRMT1 die Bildung des sogenannten CDK4/Cyclin D3-Komplexes, der von entscheidender Bedeutung für den Zellzyklus ist. Auf diese Weise kann die Zellvermehrung blockiert werden“, erläutert David Medgyesi, Projektleiter im Labor von Michael Reth (siehe Abb. 2).
Es war bereits bekannt, dass in vielen Tumorzellen das BTG2-Gen stillgelegt worden ist. Dies gilt beispielsweise auch für die akute B-Zell lymphoblastische Leukämie, die häufigste Art von Krebs bei Kindern. Den Freiburger Forscher gelang es im Mausmodell, BTG2 in Tumorzellen wiedereinzubringen und somit die unkontrollierte Zellvermehrung und das Tumorwachstum zu stoppen. „Wir haben entdeckt, wie BTG2 als Tumorsuppressor in prä-B-Zellen arbeitet und dies kann hoffentlich dazu beitragen, auch andere B-Zell-Leukämien besser zu verstehen und zu behandeln”, sagt Michael Reth. „So wäre es denkbar, die Funktion von BTG2 auch in anderen B-Zell-Tumoren zu aktivieren.” Für das Team um Michael Reth kommt es nun darauf an, besser zu verstehen, wie genau BTG2 in den Zellen reguliert wird und wie sich daraus auch etwaige Behandlungsmöglichkeiten für Patientinnen und Patienten mit B-Zell-Tumoren ableiten lassen.
MR/MR

