Gut vorbereitet
Wie der Stoffwechsel von Immunzellen flexibel bleibt
T-Zellen sind wichtige Bestandteile des Immunsystems, die uns vor Infektionen und Krebs schützen. Sie werden aktiviert durch den Kontakt mit infektiösen Mikroorganismen, wie etwa Viren, oder durch das Auftreten von Tumorzellen. Eine T-Zell-Reaktion erfolgt charakteristisch in zwei Phasen. Nach Aktivierung vermehren sich die Zellen und verwandeln sich in kurzlebige Effektor-T-Zellen, die dazu dienen, die Krankheitsentwicklung zu verhindern. Dieser Aktivierungsschritt erfordert die Stimulation sogenannter T-Zellrezeptoren auf der Oberfläche der Immunzellen. Für ihre Aktivierung brauchen T-Zellen jedoch zusätzliche stimulierende Signale, die im weiteren Verlauf auch die Art und Weise der Immunantwort prägen. Zu diesen sogenannten ko-stimulierenden Signalen zählen auch Signale des T-Zelloberflächenproteins CD28.
In der zweiten Phase der Immunantwort wandelt sich ein kleiner Teil der aktivierten T-Zellen in langlebige Gedächtniszellen um, die noch Monate oder Jahre später vor einer Neuinfektion durch den gleiche Angreifer schützen. Neuere Forschungsergebnisse konnten zeigen, dass diese verschiedenen Phasen der T-Zell-Reaktion an umfangreiche Veränderungen des Stoffwechsels in den Immunzellen gekoppelt sind. Der Zellstoffwechsel spielt somit eine entscheidende Rolle für die Funktionsweise und Entwicklung der T-Zellen.
Flexibilität der Mitochondrien ist entscheidend für T-Zellen
Im Mittelpunkt des Zellstoffwechsels stehen die verschiedenen Prozesse, bei denen die Mitochondrien, die Kraftwerke unserer Zellen, mit Nährstoffen versorgt werden, um dadurch vielfältige Zellfunktionen wahrzunehmen, einschließlich die der Energieerzeugung. Mitochondrien sind hochdynamische Gebilde und können ihre Struktur stark verändern, was letztlich auch in diesen Organellen selbst zu funktionellen Veränderungen führt. „Die Umprogrammierung des Zellstoffwechsels wird durch Schlüsselsignale der Zellrezeptoren gesteuert und kann direkt in den Formen und Größen der T-Zellmitochondrien beobachtet werden”, sagt Erika Pearce, Direktorin am Max-Planck-Institut in Freiburg. In früheren Studien waren sie und ihr Labor in der Lage, die verschiedenen Stoffwechselprogramme der T-Zellen mit unterschiedlichen Morphologien der Mitochondrien zu verknüpfen. Während aktivierte Effektor-T-Zellen mit ihrem hohen Energiebedarf zur Bekämpfung von Krankheiten runde und punktförmige Mitochondrien haben, zeigen die langlebigen T-Gedächtniszellen miteinander verschmolzene, röhrenartige Mitochondrienetzwerke, die mit ihren niedrigeren Stoffwechselanforderungen korrelieren.
„Dennoch blieb lange unklar, welche frühen Signalmechanismen zu dieser Flexibilität der Mitochondrien führen und so den T-Zellen dabei helfen, ihren Stoffwechsel an die jeweiligen Anforderungen anzupassen. Das Verständnis dieser Fragen ist aber wichtig, weil Fehlsteuerungen des T-Zellstoffwechsels stark mit Autoimmunerkrankungen, chronischen Entzündungen oder auch Krebs assoziiert sind“, erklärt Pearce.
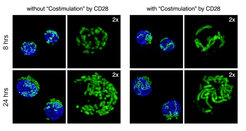
In der neuesten Studien ihres Labors, veröffentlicht im Fachjournal Cell, konnten sie und ihr Team die Bedingungen der Flexibilität der Mitochondrien genauer aufklären. Ramon Klein Geltink, Postdoktorand im Freiburger Labor von Pearce, konnte dabei zeigen, dass die Mitochondrien bereits frühzeitig nach der anfänglichen Aktivierung zu Beginn der Immunantwort vorübergehende Veränderungen in Form, Struktur und Funktion durchlaufen, die in vielerlei Hinsicht die Eigenschaften der späteren Mitochondrien der T-Gedächtniszellen nachahmen. Diese nur flüchtigen Veränderungen sind, wie die Daten der Forscherinnen und Forscher zeigen, abhängig von der Kostimulation seitens T-Zelloberflächenproteins CD28 und essentiell für die Fähigkeit der Zellen im späteren Verlauf der Immunantwort robuste T-Gedächtniszellen zu bilden.
Das Geheimnis zur Bildung langlebiger, funtionstüchtiger T-Gedächtniszellen?
„Es war bereits bekannt, dass während der T-Zell-Aktivierung Signale von CD28 für die Bildung von T-Gedächtniszellen wichtig sind. Aber wie genau dieses frühe Signal, das ausschließlich bei der anfänglichen Aktivierung vorhanden ist, zu den Funktionen der viel später gebildeten T-Gedächtniszellen beiträgt, war bisher nicht erforscht“, erklärt Klein Geltink, Erstautor der Studie.
Ausgehend von ihren Daten vermuten die Forscher, dass die frühen Signale zu einer lang andauernden Veränderung der allgemeinen Flexibilität der Mitochondrien führen. So können sich die Immunzellen auch später noch, wenn die Immunantwort in anderen Phasen voranschreitet, an die ändernden Stoffwechselanforderungen anpassen. Klein Geltink und Pearce vermuten zudem, dass darin eines der Geheimnisse liegt, um funktionstüchtige T-Zellen für das immunologische Gedächtnis zu bilden.
Die neuen Erkenntnisse der Max Planck Forscher und ihrer Kollegen könnten auch Auswirkungen auf die medizinischen Praxis haben. Bedenkt man, dass Signale von CD28 die Funktionen von Mitochondrien verändern und so zur Langlebigkeit der Immunzellen beitragen, könnte dies zukünftig einen Weg darstellen, um Funktion und Entwicklung der Zellen auch in entsprechenden Therapien zu beeinflussen. Für Pearce und Klein Geltink ist es durchaus denkbar, dass derartige therapeutische Ansätze die Immunzellen in feindlichen Tumorgewebe widerstandsfähiger machen könnten, woraus sich beispielsweise große Vorteile für die Immuntherapie gegen Krebs ergäben. Auf der anderen Seite wäre aber auch eine pharmakologisch induzierte „Abstumpfung“ der Flexibilität denkbar, die die Therapieergebnisse für Patienten mit Autoimmunerkrankungen verbessern.
