Gestaltwandler im Kampf gegen Krebs
Erkenntnisse über Stoffwechselprozesse in T-Zellen eröffnen neue Wege für die Krebstherapie
Zellen des Immunsystems verfügen über einen Stoffwechsel, der je nach Funktion und Bedarf verändert werden kann. Forscher des Max-Planck-Instituts für Immunbiologie und Epigenetik fahndeten nach den Signalen, die entsprechende Stoffwechselveränderungen bewirken und konnten nun zeigen, dass die Struktur der Mitochondrien den Stoffwechsel entscheidend reguliert. Die Studie der Freiburger Wissenschaftler, die im Fachjournal Cell erschien, beschreibt zudem, dass die Gestalt der Mitochondrien entsprechend verändert werden kann, so dass die Fähigkeit der Immunzellen verbessert wird, Tumorzellen zu erkennen und zu zerstören.
Das Immunsystem ist dafür verantwortlich, Eindringlinge wie Bakterien, Viren aber auch Krebszellen, zu bekämpfen. Der Hauptzelltyp, der in diesen Prozess involviert ist, ist die T-Zelle. Dabei handelt es sich um eine spezielle Gruppe weißer Blutkörperchen. In den letzten Jahren konnte eine Fülle an Studien zeigen, dass Stoffwechselvorgänge von T-Zellen von entscheidender Bedeutung für ihre Funktionweise und somit auch der den Körper schützenden Immunität als solcher ist. Bisher war jedoch unklar, welche innerzellulären Signale den Stoffwechsel der T-Zellen kontrollieren. Wissenschaftler am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg (MPI-IE) konnten jetzt zeigen, dass die Struktur und Form der T-Zell-Mitochondrien den Stoffwechsel entscheidend regulieren. Die Ergebnisse der Studie zeigen zudem, dass die Gestalt der Mitochondrien entsprechend justiert werden kann, so dass die Fähigkeit der T-Zellen, Tumorzellen zu erkennen und zu zerstören, verbessert wird.
Stoffwechsel entscheidend für die Immunreaktion
Während des Verlaufs einer Immunantwort durchlaufen T-Zellen eine ganze Reihe umfangreicher Stoffwechselveränderungen. Ruhende T-Zellen befinden sich im Überwachungsmodus und haben einen sehr energiesparsamen Stoffwechsel. Sobald diese Zellen jedoch aktiviert werden, um Krankheitserreger anzugreifen, wird der Stoffwechsel reprogrammiert. Dies ist notwendig, um die energieintensiven Prozesse der Immunantwort sicherzustellen, wie etwa die Zellvermehrung oder Differenzierung in T-Killerzellen oder T-Helferzellen. Aktivierte T-Zellen setzen dabei auf die sogenannte Zellatmung. Dabei handelt es sich um einen sehr effizienten Stoffwechselprozess, der die Zellen in die Lage versetzt, aus wenigen Zuckermolekülen und Sauerstoff viel Energie zu gewinnen. Im Tumorgewebe jedoch konkurrieren T-Zellen mit Krebszellen um Nährstoffe, die jeweils beide zum Überleben benötigen. Neueste Studien haben hier verdeutlichen können, dass T-Zellen, die nicht in der Lage sind die Zellatmung effektiv zu nutzen, zwar das Tumorgewebe unterwandern, jedoch keinen hinreichenden Angriff auf die Krebszellen ausführen können.
Erika Pearce - How Does Metabolism Influence the Function of Different T Cell Types?
Sind die Krankheitserreger einmal unschädlich gemacht worden, sterben die meisten T-Zellen ab, die an der Immunreaktion beteiligt waren. Ein kleiner Teil der aktivierten T-Zellen wandelt sich jedoch in langlebige T-Gedächtniszellen um. Der Stoffwechsel von T-Gedächtniszellen beruht auf einer Oxidation von Fettsäuren, der sie in die Lage versetzt, schnell zu reagieren, sollte die Infektion oder der Krebs erneut auftreten. Versagt der Fettstoffwechsel, kann die Bildung von T-Gedächtniszellen gehemmt werden und die Immunität ist gefährdet.
„Um zu verstehen, warum bestimme Stoffwechselprozesse versagen und damit die Funktionen der T-Zellen beeinflussen, mussten wir uns den Signalmechanismen zuwenden, die dabei die Instruktionen geben” sagt die leitende Autorin der Studie und Direktorin des MPI-IE Erika Pearce.
Struktur der Mitochondrien bestimmt Stoffwechsel
Sie und ihr Team konzentrierten sich auf das Mitochondrium – „das Kraftwerk der Zelle“. Diese Organellen nehmen eine zentrale Rolle im Energiestoffwechsel ein, da sie den Hauptanteil der Zellenergie produzieren.
Ändert sich der Energiebedarf der Zelle, so ändert sich nicht nur die Anzahl der Mitochondrien, sondern diese nehmen auch sehr unterschiedliche Formen und Größen an. So gibt es Mitochondrien, die als fragmentierte Einheiten in der typisch elliptischen Form existieren. Die Zellkraftwerke können aber auch als miteinander verschmolzene, röhrenartige Mitochondrienetzwerke auftreten. In ihrer aktuellen Studie, die im amerikanischen Fachjournal Cell veröffentlicht wurde, konnten die Max-Planck Forscher zeigen, dass die jeweilige Morphologie und Organisation der Mitochondrien den Stoffwechsel der T-Zellen bestimmt.
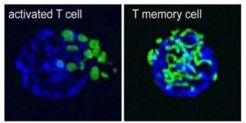
„Wir fanden heraus, dass aktivierte T-Zellen einzelne Mitochondrien haben, während die T-Gedächtniszellen fusionierte Mitochondriennetzwerke besitzen“, sagt Michael Buck, Erstautor der Studie.
Um zu testen, ob Organisation und Gestalt der Mitochondrien die Stoffwechselprogramme und somit die Immunantwort steuern, griff das Team auf verschiedene Medikamente zurück, die in aktivierten T-Zellen eine Fusion der Mitochondrien auslösen.
„Unsere Daten legen nahe, dass eine Veränderung der Struktur der Mitochondrien deutliche Auswirkungen auf den Stoffwechsel sowie die Differenzierung von T-Zellen haben“, berichtet Erika Pearce. So stellten die Wissenschaftler fest, dass aktivierte T-Zellen, in denen eine Mitochondrienverschmelzung ausgelöst wurde, Eigenschaften von T-Gedächtniszellen ausbildeten. Die behandelten Zellen zeigten nicht nur eine erhöhte Langlebigkeit, sondern auch verbesserte Fähigkeiten Tumorwachstum zu kontrollieren. Gleichzeitig regten Eingriffe, die eine Spaltung und Vereinzelung von Mitochondrien hervorriefen, die Zellatmung an, die das charakteristische Stoffwechselprogramm von aktivierten T-Zellen ist.
Vor dem Hintergrund der Ergebnisse ihrer Studie glauben die Max-Planck Forscher, dass Mitochondrien sich als spannender neuer Ansatzpunkt für die Therapie menschlicher Erkrankungen erweisen könnten. „Das richtige Stoffwechselprogramm ist entscheidend für eine schlagkräftige Immunantwort der T-Zellen. Um den Stoffwechsel von T-Zellen zu kontrollieren, scheint eine Regulation der Struktur und Organisation von Mitochondrien mithilfe von Medikamenten ein viel versprechender Weg zu sein“, sagt Erika Pearce. Michael Buck fügt hinzu: „Mit dem Fokus auf den T-Zellstoffwechsel wäre es durchaus denkbar, die Fehlfunktionen von T-Zellen in feindlichen Tumorgewebe zu verhindern oder wirksamere Immuntherapien zu entwickeln mit T-Zellen, die fitter und besser gewappnet gegen Krebszellen sind.“




