Die Rolle der Autoreaktivität für die B-Zell-Entwicklung
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Immunbiologie und Epigenetik
B-Zell-Entwicklung
B-Lymphozyten bilden zusammen mit T-Lymphozyten das sog. adaptive Immunsystem, welches im Vergleich zum angeborenen Immunsystem mehrere Tage braucht, um aktiv an einer Immunantwort teilzunehmen. Der Grund hierfür liegt darin, dass bei einer Infektion die Antigen-spezifischen Lymphozyten selektiert, aktiviert und vermehrt werden müssen – ein Vorgang, der als klonale Selektion bezeichnet wird. Als Folge dessen differenzieren die Antigen-spezifischen B-Zellen zu Antikörper-produzierenden Plasmazellen oder zu Gedächtnis-B-Zellen. Letztere können Monate bis Jahre überleben, während reife, naive B-Zellen eine Halbwertszeit von nur wenigen Tagen haben und kontinuierlich aus hämatopoetischen Stammzellen im Knochenmark nachgebildet werden.
Antikörper bestehen aus zwei identischen schweren und zwei identischen leichten Ketten, welche kovalent miteinander verknüpft sind. Diese werden von nicht-aktivierten B-Zellen im Komplex mit weiteren akzessorischen Proteinen membrangebunden auf der Oberfläche als Teil des B-Zell-Antigen-Rezeptor-Komplexes (BZR) exprimiert. Anhand des Rekombinationsstatus der Gene für Immunglobuline (Antikörper) und der Expression von weiteren bestimmten Proteinen kann die B-Zell-Entwicklung in mehrere Stadien unterteilt werden: Während in pro-B-Zellen mit der Umlagerung der Immunglobulin-Gene für die schwere Kette begonnen wird, exprimieren frühe prä-B-Zellen die schwere Kette zusammen mit den Proteinen λ5 und VpreB, welche die sogenannte Ersatz-leichte-Kette bilden, in Form eines prä-B-Zell-Antigen-Rezeptors (prä-BZR) auf ihrer Oberfläche; Signale des prä-BZR führen dann dazu, dass in späten prä-B-Zellen die Umlagerung der leichten Kette eingeleitet wird. Schließlich werden die erfolgreich rekombinierten schweren und leichten Ketten als Teil des B-Zell-Antigen-Rezeptor-Komplexes auf unreifen B-Zellen exprimiert. Weitere vom BZR ausgehende Signale entscheiden dann darüber, ob die B-Zelle das Knochenmark verlassen darf und in peripheren lymphatischen Organen den Reifestatus erlangt.
Toleranzmechanismen bei B-Zellen
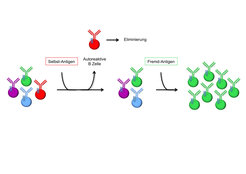
Die schweren und leichten Ketten der Antikörper bestehen jeweils aus einem variablen und einem konstanten Bereich, wobei nur der variable Bereich für die spezifische Erkennung des Antigens verantwortlich ist. Das Gen für die variable Domäne besitzt eine ungewöhnliche Struktur: es ist aufgeteilt in variable (V-), diversity (D-) und joining (J-) Gensegmente, von denen jeweils mehrere unterschiedliche Varianten im Genom vorliegen. Eine sich entwickelnde B-Zelle muss jeweils ein V- mit einem D- und einem J- (im Falle der schweren Kette) bzw. ein V- mit einem J-Gensegment (bei der leichten Kette) in einem zufälligen Rekombinationsvorgang miteinander verknüpfen, um ein funktionelles Gen zu generieren. Unter anderem bewirkt dieser Mechanismus, dass jede einzelne B-Zelle Immunglobuline mit einer einzigen Spezifität produziert, darunter jedoch auch Spezifitäten gegen körpereigene Strukturen (Autoantigene). Autoreaktive B-Zellen können maßgeblich an der Entstehung von Autoimmunerkrankungen wie Systemischer Lupus Erythematodes (SLE) oder Rheumatoide Arthritis (RA) beteiligt sein. Es wurde bisher angenommen, dass solche Zellen schon früh in ihrer Entwicklung aus dem Repertoire entfernt werden, noch bevor sie sich zu zirkulierenden, reifen B-Zellen entwickeln können (Abb. 1).
Dies wurde durch die transgene Expression des autoreaktiven 3-83 BZR (welcher MHC-I Proteine erkennt, die auf nahezu allen kernhaltigen Zellen exprimiert werden) veranschaulicht, welche dazu führt, dass keine reifen B-Zellen mit dieser Spezifität in lymphatischen Organen wie der Milz nachgewiesen werden können [1]. Man nimmt an, dass die Expression eines autoreaktiven B-Zell-Antigen-Rezeptors zum programmierten Zelltod der jeweiligen unreifen B-Zellen führt, noch bevor diese das Knochenmark verlassen können – ein Mechanismus, der als klonale Deletion bezeichnet wird. Darüber hinaus wurden Toleranzmechanismen wie receptor editing oder Anergie beschrieben. Beim receptor editing führt die B-Zelle sekundäre Umlagerungen der Gene für die leichte Kette durch, wodurch eine neue leichte Kette generiert wird, die gepaart mit der vorhandenen schweren Kette eine neue Spezifität ergeben kann. Der Mechanismus der Anergie ist noch nicht vollständig verstanden. Man weiß allerdings, dass anergische B-Zellen die Oberflächenexpression der Immunglobuline herunterregulieren und sie in einen reaktionsunfähigen Zustand versetzt werden [2].
Die Selektion von B-Zellen
Die Oberflächenexpression der Immunglobuline als prä-BZR bzw. BZR auf sich entwickelnden B-Zellen signalisiert der Zelle die erfolgreiche Rekombination der Immunglobulin-Gene. Dies ist enorm wichtig, da beim oben beschriebenen Vorgang der Rekombination der Immunglobulin-Gene mehrmals DNA-Doppelstrangbrüche entstehen, die wieder verknüpft werden müssen. An den Verknüpfungsstellen können zusätzliche Nukleotide eingefügt werden, welche die Variabilität im Immunglobulin-Repertoire erhöhen. Hierbei liegt jedoch das Problem darin, dass nach der erfolgten VDJ-Rekombination das DNA-Leseraster des Immunglobulin-Gens verschoben sein kann, wodurch kein funktionsfähiges Protein mehr gebildet werden kann. Deshalb müssen B-Zellen, die diesen Prozess erfolgreich umgesetzt haben und eine funktionelle schwere Kette exprimieren, positiv selektioniert werden. Die intakten schweren Ketten bilden zusammen mit einer invarianten Ersatz-leichten-Kette einen prä-BZR, dessen Signale dann zu einer Expansion der jeweiligen prä-B-Zellen führen. Dass der prä-BZR autoreaktive Eigenschaften besitzt, wurde unter anderem von der Arbeitsgruppe von Hassan Jumaa nachgewiesen [3, 4, 5]. Die Gruppe konnte zeigen, dass der prä-BZR an ein Zuckermolekül eines benachbarten prä-BZR bindet, was zu einer autonomen prä-BZR-induzierten Signaltransduktion und somit zur positiven Selektion von prä-B-Zellen führt [6].
Nach erfolgter Expansion der prä-B-Zellen beginnen diese mit der Rekombination der Immunglobulin-Gene der leichten Kette. Verläuft dieser Rekombinationsprozess ebenfalls erfolgreich, exprimieren die Zellen die schwere Kette zusammen mit der neu gebildeten leichten Kette als Teil des BZR-Komplexes. Überraschenderweise zeigten aufwändige Studien über die Reaktivität von BZR aus verschiedenen Entwicklungsstufen, dass die Mehrheit dieser unreifen B-Zellen autoreaktive BZR exprimieren [7]. Weiterführende Studien im Labor von Jumaa konnten zudem belegen, dass diese BZR eine funktionelle Ähnlichkeit zum prä-BZR aufweisen. In In-vitro-Experimenten konnten die Forscher zeigen, dass auch autoreaktive BZR aus unreifen B-Zellen autonom aktiv sein können, was zur Proliferation und Selektion dieser Zellen führt [3].
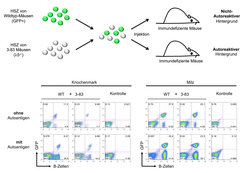
Diese Arbeiten deuten darauf hin, dass die autoreaktiven B-Zellen nicht wie bisher angenommen sofort durch klonale Deletion aus dem Repertoire entfernt werden. Vielmehr scheinen diese unreifen B-Zellen, ähnlich wie prä-B-Zellen, durch Autoantigene positiv selektioniert und angereichert zu werden. Wie bei prä-B-Zellen wird nach einigen Zellteilungsphasen die Umlagerung der Gene der leichten Kette induziert, was als sekundäre Rekombination bezeichnet wird. Die neu gebildete leichte Kette kann die Spezifität des BZR grundlegend ändern und dessen Autoreaktivität dadurch verringern. Solche Zellen beenden die Rekombination der leichten Kette-Gene und entwickeln sich weiter. Dieses neue Modell der Selektion von B-Zellen konnte von Jumaa und seinen Mitarbeitern durch Studien bestätigt werden, in denen Mäuse mit einer λ5-Defizienz verwendet wurden. Diese Tiere können keine Ersatz-leichte-Kette und somit keinen prä-BZR bilden. Die sich entwickelnden B-Zellen exprimieren stattdessen den oben beschriebenen autoreaktiven 3-83 BZR, jedoch nicht als Transgen, sondern als Knock-in in den physiologischen Genlocus. Die Forscher fanden heraus, dass dieser BZR die B-Zell-Entwicklung nur in Anwesenheit des Autoantigens (MHC-I) vermitteln konnte. Dagegen wurde eine Blockade der B-Zell-Entwicklung bei der prä-B-Zell-Stufe festgestellt, wenn das Autoantigen nicht vorhanden war.
Zudem konnte gezeigt werden, dass nach einer Transplantation von hämatopoetischen Stammzellen aus λ5-defizienten 3-83-Mäusen in immundefiziente Mäuse in Anwesenheit des Autoantigens die B-Zell-Entwicklung ähnlich effizient abläuft wie aus hämatopoetischen Stammzellen von Wildtyp-Mäusen [8]. In diesem Experiment wurden hämatopoetische Stammzellen aus Wildtyp- und 3-83-Mäusen miteinander gemischt und in immundefiziente Mäuse injiziert, welche selber keine B-Zellen generieren können. Um die hämatopoetischen Stammzellen aus den beiden Spendertieren voneinander unterscheiden zu können, exprimierten die Wildtyp-hämatopoetischen Stammzellen ein grün-fluoreszierendes Protein (GFP) als Marker. Fünf Wochen nach erfolgter Transplantation konnten in den Empfängermäusen GFP-positive und GFP-negative B-Zellen in vergleichbaren Mengen in der Milz nachgewiesen werden (Abb. 2).

Diese Ergebnisse zeigen, dass die Erkennung von Autoantigenen einen entscheidenden Vorteil für sich entwickelnde B-Zellen liefert, so dass die prä-BZR-Defizienz überwunden werden kann. Folglich scheint der prä-BZR eine Art Prototyp eines autoreaktiven Rezeptors zu sein, dessen Signale zur positiven Selektion jener Zellen führt, welche eine schwere Kette exprimieren.
Das von Hassan Jumaa postulierte Modell der positiven Selektion von B-Zellen aufgrund ihrer Autoreaktivität steht im Widerspruch zu den weiter oben beschriebenen Beobachtungen, nach denen die Expression eines autoreaktiven BZR in frühen Entwicklungsstadien zu einer Blockade der B-Zell-Entwicklung führte. Die Max-Planck-Wissenschaftler nehmen an, dass der Grund für diese Diskrepanzen wohl darin liegt, dass in früheren Experimenten autoreaktive BZR transgen exprimiert wurden, d.h. nicht von ihrem physiologischen genetischen Locus aus. Dies hat zur Folge, dass autoreaktive BZR nicht mehr durch die Rekombinationsmaschinerie modifiziert werden können. Im Gegensatz dazu wurde in der aktuellen Studie von Jumaa der autoreaktive BZR vom physiologischen Locus aus exprimiert, wodurch Regulationsmechanismen wie receptor editing weiterhin möglich sind. Tatsächlich konnte in diesem System gezeigt werden, dass die reifen B-Zellen die Autoreaktivität des BZR verlieren, da die 3-83 schwere Kette nun mit einer anderen leichten Kette gepaart war, die durch sekundäre Rekombinationen der leichten Kette-Gene generiert wurde.
Zusammenfassend besagt das Modell von Hassan Jumaa, dass autoreaktive unreife B-Zellen nicht sofort durch programmierten Zelltod aus dem Repertoire entfernt werden, solange sie die Möglichkeit besitzen, ihre Spezifität durch receptor editing zu verändern, sondern dass diese Autoreaktivität für die effiziente Entwicklung eines hochdiversifizierten Antikörperrepertoires essenziell ist (Abb. 3).


