Evolution der Immunsysteme der Wirbeltiere
Forschungsbericht (importiert) 2014 - Max-Planck-Institut für Immunbiologie und Epigenetik
Fremde oder Freunde?
Das Phänomen der Immunität ist in der belebten Welt weit verbreitet. Es findet sich nicht nur bei Pflanzen und Tieren, sondern schon bei einzelligen Organismen und dient dem Erhalt genetischer, zellulärer und bei vielzelligen Organismen auch körperlicher Integrität. Allen Formen der Immunität liegt die Unterscheidung zwischen Selbst und Fremd (Nicht-Selbst) zugrunde, wobei verschiedene Organismen zu diesem Zweck im Laufe der Zeit ganz unterschiedliche Systeme herausgebildet haben. Bei Studien zur Evolution und Funktion der Immunsysteme verschiedener Tierarten werden deshalb unter anderem die folgenden Fragen bearbeitet: Gibt es grundlegende, allen Wirbeltieren gemeinsame Organisationsprinzipien? Welche artspezifischen Besonderheiten haben sich im Laufe der Evolution herausgebildet? Lassen sich Immunfunktionen ausgestorbener Tiere wenigstens in Teilen rekonstruieren? Mit der Beantwortung dieser und ähnlicher Fragen sollen sowohl ein tieferes Verständnis der Immunität erreicht als auch die Grundlagen dafür geschaffen werden, Teile des Immunsystems für therapeutische Zwecke künstlich herzustellen.
Die Immunsysteme der Wirbeltiere
Im Laufe der Evolution wurden für die Immunabwehr verschiedenste Lösungen gefunden. Ob ihrer Leistungs- und Anpassungsfähigkeit besonders eindrucksvoll sind dabei die Immunsysteme der Wirbeltiere. Diese Tiergruppe entstand vor etwa 500 Millionen Jahren und bevölkert in zwei Grundformen alle Ökosysteme der belebten Welt. Den etwa 100 Spezies der sogenannten Rundmäuler, deren in unseren Breiten bekannteste Vertreter die Neunaugen sind, steht die weitaus größere Gruppe der Kiefermäuler mit weit über 50.000 Arten gegenüber, zu denen der Hai ebenso gehört wie der Mensch. Vergleichende Studien der letzten Jahre haben überraschende Gemeinsamkeiten in den Organisationsprinzipien der Immunsysteme der beiden Schwestergruppen aufgedeckt [1]. So besitzen alle Wirbeltiere spezielle Zellen für die Antikörperbildung, mit denen Fremdstoffe erkannt und für das Erkennen durch sogenannte Fresszellen markiert werden können. Ein weiterer Typ von Immunzellen ist darauf spezialisiert, kranke oder infizierte Zellen zu erkennen und gezielt abzutöten. Die für die Differenzierung von Selbst und Nichtselbst genutzten Antigenrezeptoren unterscheiden sich allerdings zwischen Rund- und Kiefermäulern [2]. Dies lässt vermuten, dass sich im Immunsystem eines gemeinsamen Vorfahrens aller Wirbeltiere zunächst die verschiedenen Zelltypen herausbildeten, bevor dann, nach der Trennung in Rund- und Kiefermäuler, in einem zweiten Schritt die Ausprägung strukturell diversifizierter Antigenrezeptoren einsetzte. Diese Zweischritt-Hypothese lässt das Studium der für die Bildung von Abwehrzellen wichtigen Organe als allen Wirbeltieren gemeinsame Grundfunktion besonders interessant erscheinen. In der Abteilung Entwicklung des Immunsystems wird daher versucht, die Evolution eines dieser Organe, des Thymus, zu rekonstruieren, um damit ein vertieftes Verständnis seiner Funktion in heute lebenden Wirbeltieren einschließlich des Menschen zu erlangen.
Funktion des Thymus
Der Thymus ist ein wichtiges Organ des Immunsystems der Wirbeltiere. Er ist notwendig, um aus unreifen Zellen des blutbildenden Systems die für die Abwehr von Krankheitserregern notwendigen T (von Thymus)-Zellen zu bilden [3]. Sie töten, daher der Name Killerzellen, kranke Zellen entweder direkt ab oder arbeiten bei der Infektabwehr als sogenannte Helferzellen mit den antikörperbildenden Zellen des Immunsystems zusammen. Funktionell entscheidend für die Immunzellbildung ist die ausschließlich im Thymus vorhandene Mikroumgebung, die sich im Verlauf der Embryonalentwicklung in der Schlundregion ausbildet. Dieser Prozess vollzieht sich unter dem Einfluss eines bestimmten regulatorischen Proteins, des Foxn1 genannten Transkriptionsfaktors [4]. Foxn1 steuert die koordinierte Aktivität einer großen Anzahl von Genen, die in ihrem Zusammenwirken nicht nur für die Anlockung von Vorläuferzellen zum Thymus, sondern auch für deren nachfolgende Differenzierung in reife T-Zellen verantwortlich sind [5]. Aufgrund der zentralen Funktion von Foxn1 führen Mutationen dieses Transkriptionsfaktors bei Säugetieren zu einer schweren Immunschwäche [4].
Evolution des Thymus
Inzwischen ist bekannt, dass alle Wirbeltiere thymusähnliche Gewebe besitzen. Der vorläufige Schlusspunkt einer über hundertjährigen Forschungsanstrengung konnte in Zusammenarbeit mit einer amerikanischen Arbeitsgruppe kürzlich gesetzt werden, als es gelang nachzuweisen, dass auch die Rundmäuler im Rachenraum thymusähnliche Strukturen, die sogenannten Thymoide, besitzen [6]. Weiterführende Studien zur Thymusfunktion bei Fischen zeigten, dass neben dem Foxn1 Transkriptionsfaktor auch sein evolutionärer Vorläufer, Foxn4, vergleichbare Funktionen in der Mikroumgebung des Thymus übernehmen kann [7]. Dies lässt vermuten, dass beim Übergang von den einfach gebauten wirbellosen Tieren zu den komplexeren Wirbeltieren die Funktion eines ursprünglichen Thymus nicht durch Foxn1, sondern möglicherweise durch Foxn4 gewährleistet wurde. Geleitet von dieser Hypothese, ersetzten die Freiburger Forscher im Thymus von Mäusen die Funktion von Foxn1 mit der von Foxn4, dem ursprünglichen Faktor.
Überraschenderweise zeigte sich dabei, dass eine solcherart gebildete Mikroumgebung nicht nur wie erwartet die T-Zellentwicklung unterstützte, sondern zugleich auch der Entwicklung antikörperbildender B-Zellen Raum bot. Detaillierte Analysen ergaben einen zweiten überraschenden Befund. Die B-Zellen entwickelten sich in einer anatomisch abgegrenzten Region des Thymus, und zwar in der Nähe der den Thymus versorgenden Blutgefäße (Abb. 1). Diese Strukturen ähneln denjenigen, die die B-Zellen im Knochenmark vorfinden, ihrem eigentlichen Bildungsort.
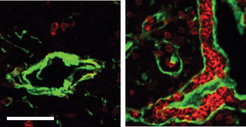
In weiteren Studien soll nun geklärt werden, ob evolutionär noch ältere Formen des Foxn4-Faktors gleiche oder ähnliche Funktionen haben. Von besonderem Interesse ist dabei die Frage, ob die aus vergleichenden Studien abgeleitete, schrittweise Entwicklung der T-Zelldifferenzierung rekapituliert werden kann. Damit könnte der entwicklungsgeschichtlichen Sequenz der T-Zellreifung eine evolutionäre Abfolge zugrunde gelegt werden.
Ausblick: Herstellung künstlicher Thymusgewebe
Die Aufdeckung der den Immunsystemen der Wirbeltiere gemeinsamen Merkmale erlaubt es, die Entwicklung künstlicher immunstimulierender Gewebe in Angriff zu nehmen. Diese Anstrengungen haben nicht nur den Zweck, die Richtigkeit der Schlussfolgerungen aus vergleichenden Studien zu bestätigen, getreu dem Feynmanschen Diktum “What I cannot create, I do not understand”, sondern sie stellen auch erste Schritte in Richtung einer klinischen Anwendung dar. Sollte es beispielsweise eines Tages gelingen, dem Thymus nachempfundene künstliche Gewebe zu schaffen, so könnten diese helfen, eine im Alter oder nach Behandlung von Tumorerkrankungen häufig auftretende Immundefizienz zu mildern. Dazu ist es nötig, die das Thymusgewebe auszeichnenden Funktionen auf deren präzise molekulare Grundlagen zurückführen zu können, um sie dann schrittweise und von Grund auf neu aufzubauen.
Literaturhinweise
Nature Reviews Immunology 11, 307-317 (2011)
DOI: 10.1038/nri2944
Advances in Immunology 109, 125-157 (2011)
DOI: 10.1016/B978-0-12-387664-5.00004-2
Lancet 2, 748-749 (1961)
Nature 372, 103-107 (1994)
Cell 149, 159-172 (2012)
DOI: 10.1016/j.cell.2012.01.049
Nature 470, 90-94 (2011)
DOI: 10.1038/nature09655
Cell Reports 8, 1184-1197 (2014)
DOI: 10.1016/j.celrep.2014.07.017
