Organellen ins rechte Licht gerückt – Filme aus den metabolischen Zentren von Immunzellen
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für Immunbiologie und Epigenetik
Immunzellen verändern ihren Stoffwechsel und bringen Abwehrprogramme ins Rollen
Der Mensch ist ständig einer Vielzahl von infektiösen Mikroorganismen, Bakterien, Pilzen und Viren ausgesetzt. Dass wir dennoch nicht ständig erkranken, verdanken wir der schnellen Reaktionsfähigkeit unseres Immunsystems. Die meisten unserer Immunzellen befinden sich zunächst in einem ruhenden oder schlafenden Zustand. Entdecken sie aber Pathogene oder Bestandteile infektiöser Organismen, durchlaufen sie innerhalb weniger Stunden bis Tage ein Aktivierungsprogramm: Sie fangen an zu wandern, um Pathogene einzugrenzen, vermehren sich, setzen anti-pathogene Moleküle frei und produzieren große Mengen entzündungsfördernder Substanzen.
Um diese Prozesse zu ermöglichen, reprogrammieren Immunzellen ihren Stoffwechsel. Dies ist nötig, um sicherzustellen, dass sowohl der zelluläre Energiebedarf gestillt als auch die Produktion neuer Zellbestandteile gewährleistet ist. In den letzten zehn Jahren wurde deutlich, dass Immunzellen spezifische Stoffwechselprogramme nutzen, um einen bestimmten Aktivierungszustand zu erreichen [1]. So sind aktivierte Fresszellen (Makrophagen) oder zelltoxische Lymphozyten (T-Effektorzellen) abhängig vom Zuckerstoffwechsel (Glykolyse), wohingegen Immunzellen, die sich in einem ruhenden Zustand befinden, den mitochondrialen Fettstoffwechsel nutzen (beta-Oxidation). Während mittlerweile als gesichert gilt, dass der Stoffwechsel von Immunzellen Einfluss auf deren Aktivierungsstatus nehmen kann, ist noch immer unklar, wie diese metabolischen Prozesse etabliert und erhalten werden.
Organellen wirken als metabolische Schalt- und Kommunikationszentralen
In unseren Zellen sind Stoffwechselprozesse räumlich unterteilt, unter anderem in membran-umhüllten Kompartimenten wie den Organellen. Dazu gehören die Mitochondrien, die schon lange als besondere metabolische Einheit definiert und als Energiezentrum unserer Zellen gelten. Heutzutage wissen wir, dass auch viele andere Organellen, wie Autophagosomen, Lipidkörper oder Lysosomen, sowohl einzeln als auch im Verband mit anderen Organellen wichtige Stoffwechselwege regulieren können.
Organellen sind grundsätzlich sehr dynamische Strukturen; sie verändern ständig ihre Form, Position oder Interaktion mit anderen Organellen. Diese dynamischen Veränderungen bilden die Grundlage der Organellenkommunikation, die gewährleistet, dass Organell-spezifische Stoffwechselwege integriert werden und die Zelle als metabolische Einheit wirken kann. Während man in vielen Zelltypen bereits Kommunikationswege zwischen den Organellen definieren konnte [2, 3], sind diese Prozesse in Immunzellen noch weitgehend unverstanden. Der Fokus der Forschungsgruppe liegt darin zu verstehen, wie Organellen zusammenarbeiten, um Stoffwechselprogramme von Immunzellen zu regulieren. Die Wissenschaftler bedienen sich hierbei moderner, hochauflösender Lebendzellmikroskopie. Diese erlaubt ihnen, gleichzeitig verschiedene Organellen in lebenden Zellen zu erfassen und Veränderungen in deren Verhalten im Verlauf einer Immunantwort zu beobachten. Von den daraus resultierenden Ergebnissen erwarten die Wissenschaftler die Identifizierung von Molekülen, die das Verhalten von Immunzellen regulieren und somit die Erkennung potentieller therapeutischer Angriffspunkte für die Beeinflussung von Infektionen und Immunerkrankungen.
Mitochondrienkommunikation reguliert metabolische Immunprozesse
Hunderte bis Tausende von Mitochondrien liegen in unseren Zellen vor, wobei die einzelnen Mitochondrien-Elemente durch abwechselnde Fusion und Teilung ständig miteinander in Kontakt stehen. Kürzlich zeigten Studien, dass diese Form der Kommunikation von besonderer Bedeutung ist, wenn Zellen ihren Stoffwechsel von Zucker- auf Fettabbau umstellen müssen. Unter diesen Bedingungen kommunizieren einzelne Mitochondrien und verschmelzen zu einem einzigen großen Netzwerk [3]. Aufbauend auf diesen Ergebnissen konnten die Forscher nun zeigen, dass die Fusion von Mitochondrien auch eine besondere Bedeutung für die Stoffwechselveränderungen spezieller T-Lymphozyten (kurz: T Zellen) und deren Entwicklung hat. T Zellen sind ein wichtiger Bestandteil unserer erworbenen Immunantwort. Hierbei entwickeln sich T Zellen zu verschiedenen Unterformen. Als T-Effektorzellen erkennen sie erkrankte Zellen und töten diese ab. Entwickeln sich diese weiter zu T-Gedächtniszellen, dann überleben diese jahrelang in unserem Körper und können uns vor erneuten Infektionen schützen.

Interessanterweise entwickelt der Stoffwechsel von Gedächtniszellen eine Abhängigkeit von Fetten, was sie von den T-Effektorzellen, die besonders abhängig von Zuckern sind, deutlich unterscheidet. Durch Lebendzellmikroskopie konnten die Forscher kürzlich darstellen, dass T-Effektor- und T-Gedächntiszellen deutlich unterschiedliche Mitochondrienformen annehmen [4]: Während Effektorzellen einzelne fragmentierte Mitochondrien aufweisen, verschmelzen Mitochondrien in Gedächtniszellen zu gut ausgebildeten Netzwerken (Abb. 1).
In Zusammenarbeit mit dem Labor von Erika Pearce, die ebenfalls am Max-Planck-Institut für Immunbiologie und Epigenetik forscht, gelang der Nachweis, dass diese Verschmelzung eine wichtige Rolle für die Stoffwechselaktivität und somit die Entwicklung von Gedächtniszellen spielt. Diese Untersuchungen bilden nun die Grundlage für weitere Studien, in denen analysiert wird, ob andere Immunzelltypen ebenfalls mitochondriale Netzwerke nutzen, um Einfluss auf die Aktivität und Entwicklung spezifischer Immunzellstadien zu nehmen.
Organellen-Kommunikation und deren Bedeutung für Immunerkrankungen
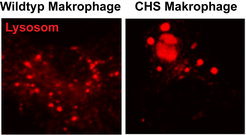
Neben den Mitochondrien steht auch die Untersuchung von Lysosomen, einem anderen Zellorganell, im Zentrum des Interesses. Lysosomen sind zumeist als das Abfall- und Recyclingsystem einer Zelle bekannt. Aufgenommene und intrazelluläre Bestandteile werden darin in ihre Einzelbausteine (Fette, Zucker, Aminosäuren) zerlegt und der Zelle anschließend wieder zugeführt. Wie wichtig die einwandfreie Funktion von Lysosomen für unsere Gesundheit ist, verdeutlicht die Vielzahl an Erkrankungen, die durch lysosomale Defekte ausgelöst werden. Eine dieser Immunerkrankungen wird auch von Wissenschaftlern der Forschungsgruppe genauer untersucht: Das Chediak Higashi Syndrom. Betroffene Patienten leiden unter schweren, wiederkehrenden Infektionen, da ihre Immunabwehr bestimmte pathogene Eindringlinge nicht mehr unschädlich machen kann. Viele der Betroffenen durchlaufen zudem eine hoch entzündliche Phase, die durch die unkontrollierte Vermehrung verschiedener Immunzellen (Fresszellen und zelltoxische T-Zellen) charakterisiert ist. Die einzige Heilungschance des Chediak Higashi Syndroms liegt bisher in der Knochenmarkstransplantation, die jedoch nur möglich ist, wenn rechtzeitig ein geeigneter Spender gefunden werden kann.
Während über die genauen Mechanismen der Erkrankung noch nicht viel bekannt ist, gilt es als gesichert, dass deren Ursache Defekte in einem Protein, dem sogenannten lysosomal trafficking regulator (LYST), sind. Veränderungen in LYST führen zu veränderten lysosomalen Fusions- und Teilungszyklen und somit zur Bildung von riesigen Lysosomen. Hochauflösende Lebendzellmikroskopie wird nun von den Forschern des Rambold-Labors angewandt um diesen Organellendefekt genauer zu analysieren (Abb. 2).
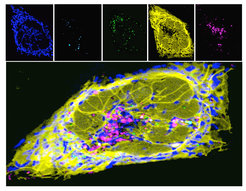
Von besonderem Interesse ist hierbei nicht nur das Lysosom selbst, sondern auch die Aktivität von anderen Organellen zu testen, die normalerweise mit Lysosomen zusammenarbeiten (Abb. 3).
Die Isolation derart veränderter Organellen-Netzwerke könnte es den Wissenschaftlern erlauben, neue Ansatzpunkte in der Behandlung dieser schweren Erkrankung zu identifizieren. Zudem erhoffen sich die Forscher von ihren Arbeiten neue grundlegende Erkenntnisse von den molekularen Prozessen der Organell-getriebenen Immunantwort, die die optimale Balance zwischen dem Schutz vor Erregern und unerwünschten immunologischen Überreaktionen gewährleistet.