Chromatinregulierung in Fliegenembryonen
Max-Planck-Forschung zeigt unerwartete Funktionalität von Schlüsselmolekülen der Embryonalentwicklung
Histonacetyltransferasen gelten als Schlüsselmoleküle für die Aktivierung der Transkription von Genen. Lange Zeit wurde ihr Beitrag zur Aktivierung der Transkription mit ihrer enzymatischen Funktion in Verbindung gebracht. Das Labor von Nicola Iovino am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg hat die Rolle der beiden wichtigsten Histon-Acetyltransferasen, CBP und Gcn5, bei der Aktivierung des embryonalen Genoms der Fruchtfliege untersucht. Das Team fand heraus, dass die beiden Moleküle die Aktivierung des embryonalen Genoms steuern, indem sie unterschiedliche Gruppen von Genen regulieren. Überraschenderweise zeigte sich auch, dass die enzymatische Aktivität von CBP und Gcn5 für die Genaktivierung während dieses Entwicklungsfensters nicht notwendig ist.
Am Anfang der Embryonalentwicklung ist das Genom noch ganz still. Das Embryo hat noch keine eigenen Gene aktiviert, sondern überlebt die ersten Stunden oder gar Tage nur mithilfe von Eiweißen und Genprodukten, die zuvor von der Mutter eingelagert wurden. Sobald dieser mütterliche Beitrag wegfällt, führt der Prozess der zygotischen Genomaktivierung (ZGA) den Embryo in einen Zustand, indem es tausende seiner eigenen Gene gleichzeitig anschaltet und die Entwicklung weiter voranschreitet.
Damit dieser Start in ein eigenständiges Leben gelingt, müssen im Embryo innerhalb eines kurzen Zeitfensters zahlreiche Prozesse präzise orchestriert werden. Das Labor von Nicola Iovino am Freiburger Max-Planck-Institut für Immunbiologie und Epigenetik erforscht, wie das Genom auf diesen Übergang in die Selbstständigkeit vorbereitet wird und welche Moleküle daran beteiligt sind.
„Die DNA liegt nicht einfach nackt im Zellkern vor, sondern ist um Proteinkügelchen gewickelt gewickelt. Diese verpacken die DNA. Den Komplex aus Proteinkugeln und Erbgut nennt man Chromatin,“ sagt Nicola Iovino, Gruppenleiter am Max-Planck-Institut in Freiburg Verschiedene Chromatinfaktoren können kleine Moleküle, die Acetylgruppen, von den Proteinkügelchen entfernen oder an sie anheften. So können Sie den Verpackungsgrad der DNA verdichten oder lockern und, je nachdem, die Gene an der Stelle stilllegen oder ablesbar machen. „Wir wollen verstehen, was dafür früh im Genom des Embryos passieren muss und welche Faktoren notwendig dafür sind, dass das Embryo sein Genom aktiviert,“ erklärt Nicola Iovino.
Histon-Acetyltransferasen regulieren verschiedene Gengruppen
Das Labor forscht an der Fruchtfliege Drosophila melanogaster, die sich aufgrund ihrer kurzen Generationszeit und leichten genetischen Veränderbarkeit besonders gut eignet, um mehr über epigenetische Prozesse zu erfahren. Mit Hilfe eines genetischen Screenings konnte das Team um Nicola Iovino in dieser Studie den Beitrag vieler wichtiger Chromatinfaktoren, wie der Polycomb-Gruppenproteine und anderer bereits bekannter Enzyme, während der ZGA bestätigen. Angesichts der Expertise des Labors in der Untersuchung von Chromatinfunktionen auch in anderen Entwicklungskontexten beschloss das Team, sich in dieser Studie auf die Rolle von zwei wichtigen Chromatinfaktoren zu konzentrieren: CBP und Gcn5. Diese beiden so genannten Histon-Acetyltransferasen (HATs) sorgen durch das Anhängen von Acetylgruppen (Acetylierung) dafür, dass die Proteinkügelchen weniger fest an die DNA gebunden sind und die Gene leichter aktiviert werden können.
„Wir haben herausgefunden heraus, dass CBP und Gcn5 unterschiedliche Funktionen bei der Regulierung des embryonalen Genoms haben. CBP aktiviert vermehrt echte „Entwicklungsgene“, also Gene für frühe Entwicklungsfunktionen wie die Musterbildung oder die Festlegung des Zellschicksals; während Gcn5 mehr „Haushaltsgene“ einschaltet, also Gene, die für die Aufrechterhaltung der Grundfunktionen jeder Zelle notwendig sind. Außerdem nutzen sie unterschiedliche Lysinsubstrate, also unterschiedliche Stellen auf den Proteinkügelchen, um ihre Wirkung zu entfalten,“ erklärt Filippo Ciabrelli, Erstautor der Studie.
Aufgrund dieser Spezialisierung von CBP und Gcn5 bei der Genregulation im jungen Genom erwartete das Team, dass sich diese beiden Histon-Acetyltransferasen vor allem auf ihren jeweiligen Zielgenen anreichern würden. Überraschenderweise fanden sich jedoch die Acetylierungsmarkierungen von CBP und Gcn5 auf jedem Gen des Fruchtfliegenembryos während der ZGA. „Das hat uns mehr als verblüfft und wir haben begonnen, die eigentliche Rolle von CBP und Gcn5 in diesem Entwicklungsstadium erstmals zu überdenken“, sagt Nicola Iovino.
Enzymatische Aktivität für Genaktivierung nicht erforderlich
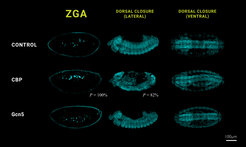
Werden CBP und Gcn5 bzw. ihre funktionellen Proteine durch RNA-Interferenz vollständig ausgeschaltet, führt dies erwartungsgemäß dazu, dass die ZGA nicht initiiert wird und die Embryogenese gestört ist. Als das Team jedoch spezielle Fruchtfliegenembryonen erzeugte, die katalytisch inaktive Versionen der beiden Histon-Acetyltransferasen besitzen, konnten sie beobachten, dass die Embryonen dennoch lebensfähig waren und ihren Lebenszyklus erfolgreich vollendeten. „Es zeigte sich sogar, dass trotz fehlender katalytischer Aktivität von CBP und Gcn5, also der Fähigkeit den Verpackungszustand des Erbguts in den Fliegenmutanten in diesem Entwicklungsstadium zu verändern, auch die Expression der Zielgene CBP Gcn5 nicht beeinträchtigt wurde,” erklärt Nicola Iovino.
Um die Aussagekraft ihrer Beobachtungen zu erhärten, wandte sich das Team an Vincent Loubiere vom Institut für Molekulare Pathologie in Wien. Loubieres experimenteller Beitrag klärte auf, wie sowohl CBP- als auch Gcn5-Proteine ein Reportergen in vitro transaktivieren können, ohne dass die jeweiligen katalytischen Aktivitäten benötigt werden. „Diese Ergebnisse bestätigen, was Iovino und sein Team bereits in ihrem In-vivo-Modell beobachtet hatten“, sagt Vincent Loubiere.
Damit belegt die Studie erstmals, dass die Proteine Gcn5 und CBP auch ohne ihre katalytische Aktivität eine wichtige Rolle in der frühen Entwicklung der Fruchtfliege spielen. Die Ergebnisse zeigen, dass die enzymatische Aktivität dieser Schlüsselmoleküle in einem kritischen Stadium der Embryonalentwicklung nicht notwendig ist und ergänzen die wachsende Zahl von Belegen dafür, dass einige Enzyme, die an der Modifizierung der DNA-Verpackung beteiligt sind, auch ohne ihre katalytische Aktivität funktionieren können.
NI/MR












