Evolution der Immunrezeptor-Vielfalt
Wie das Immunsystem lernte, selbst und fremd zu unterscheiden
Unser Immunsystem ist in der Lage, nahezu jede chemische Struktur zu erkennen. Doch wie kommt es zu dieser erstaunlichen Unterscheidungskraft und warum greifen Immunzellen nur infiziertes oder krankes, nicht aber gesundes Gewebe an? Vor etwa 50 Jahren entdeckten Wissenschaftler, nach welchem Prinzip Antikörper und zelluläre Rezeptoren, sogenannte T-Zell-Rezeptoren (TCRs), während der Entwicklung zusammengesetzt werden. Ähnlich wie Zahlen beim Lotto werden Einzelteile von Genen in kombinatorischer Weise miteinander verknüpft, um funktionelle Antigenrezeptoren zu erzeugen. Auf diese Weise können Milliarden von Kombinationen aus einer kleinen Anzahl genetischer Elemente entstehen. Es blieb jedoch bislang unklar, wie zum Zeitpunkt der Entstehung dieses als somatische Rekombination bezeichneten Mechanismus eine immunologisch vorteilhafte erweiterte Rezeptordiversität gegen das Risiko einer unbeabsichtigten Selbsterkennung und -zerstörung abgeglichen werden konnte. Wissenschaftler des Max-Planck-Instituts für Immunbiologie und Epigenetik in Freiburg machen dazu nun einen Lösungsvorschlag. Sie entdeckten einen überraschend einfachen molekularen Mechanismus, mittels dessen die Sequenzvielfalt von Antigenrezeptoren zunächst sehr eingeschränkt, dann aber im Laufe der 500 Millionen Jahre dauernden Evolution der Wirbeltiere immer größer werden konnte. Sie vermuten, dass die anfänglichen Einschränkungen Raum gaben für die Entwicklung spezialisierter Selbsttoleranzmechanismen, als Voraussetzung für eine stetig zunehmende Rezeptordiversität ohne Risiko unerwünschter Kollateralschäden.
Immunrezeptoren werden von Lymphozyten exprimiert, einem Typ weißer Blutkörperchen, der in primären Immunorganen wie der Thymusdrüse und dem Knochenmark gebildet wird. Bevor Lymphozyten jedoch aus diesen Organen auswandern dürfen, werden sie einem strengen Selektionsprozess unterzogen, bei dem alle Lymphozyten, die potenziell selbstreaktive Rezeptoren exprimieren, entfernt oder inaktiviert werden. Wenn dieser Toleranzschritt nicht ordnungsgemäß durchgeführt wird, kann es zur Autoimmunität kommen, die Paul Ehrlich vor mehr als 100 Jahren als „Horror Autotoxicus“ beschrieben hat. Als Karl Landsteiner in den 1920er Jahren entdeckte, dass unser Körper Antikörper gegen fast jede chemische Struktur bilden und diese mit erstaunlicher Präzision unterscheiden kann, warf er ein Schlaglicht auf einer der größten Rätsel des Immunsystems. Wie, fragte die Forschung, ist es möglich, so viele spezifische Rezeptoren auszubilden, wenn die Kapazität des Genoms von Tieren nicht einmal ansatzweise ausreicht? Viele Jahrzehnte später lüftete Susumu Tonegawa den Schleier, indem er zeigte, dass Antigenrezeptorgene in einem komplizierten Rekombinationsmechanismus aus kleineren Elementen zusammengefügt werden, nicht unähnlich der Zahlenlotterie. Zum evolutionären Ursprung dieses speziellen Rekombinationsmechanismus stellte Tonegawa vor etwa 50 Jahren die „Transposon-Split-Gen“-Hypothese auf.
Springende Gene spalten Rezeptorgene
In seiner Vorstellung teilt die Insertion eines Transposons (auch als „springendes Gen“ bekannt) ein Exon eines Zelloberflächenrezeptor-kodierenden Gens in zwei Teile, die er variable (V) und verbindende (J für joining) Segmente nannte. Wieder zusammengefügt kodieren diese beiden Teile des Rezeptors die Antigenbindungsoberfläche. Aber wie könnte die Zusammenfügung ablaufen? An den Enden von Transposons finden sich charakteristische Sequenzen. Tonegawa postulierte, dass diese von speziellen Rekombinasen als Erkennungssequenzen genutzt werden, um direkt am Übergang zur zellulären DNA einen DNA-Strangbruch einzuführen. Die beiden freien Enden würden dann durch Reparaturenzyme wieder miteinander verbunden und das für die Rezeptorbildung intakte Exon wiederentstehen. Inzwischen ist diese Hypothese durch experimentelle Befunde gesichert; es wurde zudem gezeigt, dass die Versiegelung der freien Enden während des Reparaturprozesses nicht immer präzise verläuft und somit eine neben der kombinatoriellen eine zusätzliche Form der Diversität entsteht.
Diese elegante Lösung warf jedoch ein neues schwerwiegendes Problem auf. Da die Transposition und die damit verbundene Entstehung des gespaltenen V-J-Gens bei alten Wirbeltieren ein Zufallsereignis ist, erscheint es unwahrscheinlich, dass zum Zeitpunkt der Entstehung des Rekombinationsmechanismus vor etwa 500 Millionen Jahren bereits geeignete Qualitätskontrollmechanismen existierten, die zur Unterdrückung potenziell schädlicher Selbsterkennung durch die immer wieder andersartig zusammengesetzten Rezeptoren hätte dienen können.
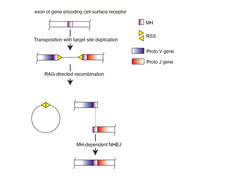
Mikrohomologie-Sequenzen geben Raum für die Entwicklung von Selbsttoleranzmechanismen
Vor dem Hintergrund dieses Rätsels beschlossen Forscher am Max-Planck-Institut für Immunbiologie und Epigenetik, die molekularen Konsequenzen der Transposon-Insertion genauer zu untersuchen. Aus Arbeiten anderer war bekannt, dass die Einfügung eines Transposons zur Verdoppelung eines kurzen Nukleotidabschnitts der Ziel-DNA führt. Könnte es sein, fragten sie, dass diese flankierenden aber identischen „Mikrohomologie“-Regionen den Reparaturprozess so beeinflussen, dass es zur Begrenzung der Verbindungsvielfalt an der versiegelten Bruchstelle kommt? Um dieser Möglichkeit nachzugehen, suchte das Team um Thomas Boehm Beweise für zwei Vorhersagen ihrer Hypothese. „Bei Individuen evolutionär älterer Arten sollten die ursprünglichen Mikrohomologiesequenzen den Rekombinationsprozesses mit dem Ergebnis geringerer Diversität beeinflussen“, erklärt Thomas Boehm, Direktor der Abteilung Entwicklungsimmunologie. Orlando Giorgetti, Projektleiter in der Abteilung und Erstautor der Studie, fügt hinzu: „Eine zweite Vorhersage ist, dass die Mikrohomologie im Laufe der Evolution immer weniger an Bedeutung verlieren und daher die Vielfalt der Antigenrezeptor-Repertoires stetig zunehmen sollte.“
Beide Vorhersagen konnten in einer umfassenden Analyse des Antigenrezeptor-Repertoires von mehr als 300 Wirbeltierarten bestätigt werden. In ihrer aktuellen Arbeit konzentrierten sich die Wissenschaftler auf das T-Zell-Rezeptor Alpha-Ketten-Gen, das zur V-J-Klasse der Antigenrezeptoren gehört und in seiner Struktur dem mutmaßlich primordialen Antigenrezeptor-Gen entspricht. Es kodiert für eine der Ketten des kanonischen heterodimeren αβ-T Zell-Rezeptor und ist ein nahezu universeller Bestandteil des adaptiven Immunsystems von Kiefermäulern.
Die neuen Ergebnisse deuten darauf hin, dass die Nutzung der molekularen Eigenschaften der Reparaturprozesse bei der V-J-Rekombination den Grad der Unsicherheit beeinflusst, der sich aus der Verbindungsdiversität ergibt. Mit anderen Worten, je besser die flankierenden Mikrohomologien erhalten sind, desto geringer ist die Diversität der Rezeptoren. Diese evolutionäre Koppelung erlaubte es nach Meinung der Wissenschaftler die Entwicklung spezialisierter Selbsttoleranzmechanismen präzise abzustimmen, eine Erhöhung der Rezeptordiversität ohne das Risiko unerwünschter Kollateralschäden zu erzielen. In zukünftigen Arbeiten wollen die Wissenschaftler um Thomas Boehm die ursprünglichen Komponenten der Toleranzmaschinerie rekonstruieren, um die evolutionären Kräfte zu beleuchten, die das menschliche Immunsystem formten.
TB/OG
Teaserbild von Dylan Nolte auf Unsplash
