Die Funktion der Cadherine bei der Musterbildung des Säugetierembryos
Forschungsbericht (importiert) 2008 - Max-Planck-Institut für Immunbiologie und Epigenetik
Cadherine errichten Zell-Zellkontakte und erhalten diese aufrecht
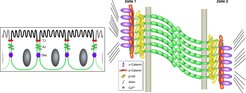
Cadherin ist der Oberbegriff einer Proteinüberfamilie von transmembranen, kalziumabhängigen Adhäsionsmolekülen. Die am besten untersuchten Vertreter sind in der Unterfamilie der klassischen bzw. Typ-I-Cadherine zusammengefasst. Zu ihnen zählen E- und N-Cadherin (E - embryonales/epitheliales bzw. N - neuronales Cadherin, benannt nach dem Gewebe, in dem sie erstmals isoliert wurden). Die prozessierten klassischen Cadherine sind im extrazellulären Teil aus fünf sich wiederholenden Motiven, den so genannten Cadherin-Domänen, aufgebaut, die tandemartig angeordnet sind und paarweise eine Bindungsstelle für Kalziumionen bilden. Die intrazelluläre Domäne ist u. a. an beta-Catenin gekoppelt, wodurch über die Bindung an alpha-Catenin eine Verankerung des Adhäsionskomplexes an das Aktin-Zytoskelett erfolgt [1]. Die Funktion der Cadherine in der Zelle lässt sich am besten am Prototyp-Molekül E-Cadherin in Epithelien veranschaulichen. Die Expression von E-Cadherin führt zur spezifischen Lokalisation an der basolateralen Membran, was maßgeblich zur Zellpolarisierung beiträgt. Konzentriert finden sich die Moleküle in den adherens junctions, die im Elektronenmikroskop von den apikal liegenden tight junctions und den basal formierenden Desmosomen unterschieden werden können (Abb. 1).
Streng kontrollierte zeitliche und räumliche Expression der Cadherine ist bei Säugetieren essentiell für eine korrekte Embryonalentwicklung . Das Fehlen von E-Cadherin führt bereits zum Absterben des Embryos während der Präimplantationsphase, da sich keine Blastozyste mit funktionsfähigem Trophektoderm bildet, das normalerweise die innere Zellmasse und Blastocoelhöhle umschließt [2]. Obwohl N-Cadherin-defiziente Embryonen erst am Tag 9.5 der Embryonalentwicklung aufgrund eines Herzdefekts absterben, ist bereits der korrekte Wechsel der Cadherin-Expression während der Gastrulation ab dem Tag E6.0 für den reibungslosen Ablauf der weiteren Entwicklung entscheidend [3]. Während dieses Vorgangs schalten Ecadherin exprimierende Zellen aus dem Ektoderm, die durch den so genannten Primitivstreifen wandern und Mesoderm bilden, das Gen ab und stattdessen das Ncadherin-Gen an. Dieses Umschalten in der Genexpression führt dazu, dass die Zellen ihre epitheliale Polarität im Verband verlieren und die Fähigkeit zur Zellwanderung gewinnen. Dieser Vorgang des Wechsels der Cadherin-Expression korreliert häufig mit bedeutenden morphogenetischen Ereignissen während der Embryonalentwicklung, wird allerdings auch oft beim Voranschreiten der Krebsentstehung beobachtet. Bei der Tumorentwicklung findet sich dieser Wechsel an der Schwelle zwischen gutartigem Adenom und bösartigem Karzinom, da durch den Wegfall von E-Cadherin der Gewebeverband aufgelöst wird und durch die Neusynthese von N-Cadherin die Möglichkeit zur Zellwanderung und Metastasierung gewonnen wird. Aufgrund der Bedeutung der Cadherine für die Embryogenese und aufgrund der Beobachtungen, die aus Analysen von Tumoren erhalten wurden, ist es wichtig zu verstehen, welche molekularen Unterschiede zwischen E- und N-Cadherin für die entgegengesetzten Eigenschaften verantwortlich sind. Ebenso dient die Aufklärung der molekularen Mechanismen der transkriptionellen Regulation der zugehörigen Gene dem Verständnis von embryonaler Musterbildung und Krebsentstehung (Abb. 2).
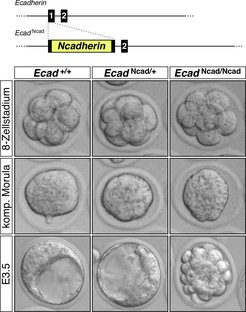
Fehlexpression von Ncadherin in der Ecadherin-Expressionsdomäne
Die Hausmaus (Mus musculus) stellt einen idealen Modellorganismus zum Verständnis embryonaler Musterbildung bei Wirbeltieren dar und wird darüber hinaus zur Erforschung molekularer Mechanismen der Tumorentwicklung herangezogen. In der Arbeitsgruppe um Marc Stemmler wird die Präimplantationsentwicklung im Hinblick auf die Beteiligung der Cadherine an diesen Vorgängen untersucht. Die beiden Mitglieder der Superfamilie E- und N-Cadherin weisen sehr hohe Übereinstimmung in der Peptidsequenz auf und binden an gemeinsame intrazelluläre Interaktionspartner [1]. Besonders bemerkenswert ist aber, dass beide Moleküle fast ohne Ausnahme in einem sich gegenseitig ausschließenden Muster im Embryo sowie im adulten Organismus exprimiert werden.
In der Arbeitsgruppe wird untersucht, welche molekularen Unterschiede zwischen beiden Vertretern der Cadherine bestehen. Ein zentraler Punkt dieser Analyse ist die Frage, ob N-Cadherin die Funktion von E-Cadherin bei der Bildung einer Blastozyste ersetzen kann. Durch das Einfügen der kodierenden Sequenz des Ncadherin-Gens in den Ecadherin-Locus kann experimentell die Genexpression bereits in der Präimplantationsentwicklung umgeschaltet werden [4]. Der Vorgang der Morula-Kompaktion, der nach dem 8-Zellstadium einsetzt, benötigt die Funktion von E-Cadherin. Wird stattdessen ausschließlich Ncadherin exprimiert, ist dieser Vorgang nicht beeinträchtigt. Jedoch ist die anschließende Bildung des Trophektoderms und die Formierung der Blastozyste in diesen Embryonen nicht mehr möglich [4]. Zwar wird das epitheliale Differenzierungsprogramm korrekt initiiert, was sich aus Untersuchungen von molekularen Markern ergeben hat, kann aber nicht abgeschlossen werden. Die Zellen runden sich ab, verlieren die charakteristische Polarität und sterben ab. Die Ergebnisse zeigen, dass N-Cadherin die Funktion von E-Cadherin bei der Morula-Kompaktion ersetzen kann, nicht aber bei der Bildung der Blastozyste. Dies streicht eine einzigartige Rolle von E-Cadherin während dieser Vorgänge heraus.
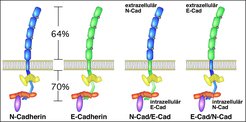
Was nun der Grund für das Scheitern von N-Cadherin als Ersatz ist und welche Eigenschaft diesem Molekül fehlt, bleibt noch zu klären. Denkbar sind Abweichungen in der Adhäsionskraft, die bei N-Cadherin unzureichend ist, bisher unentdeckte Unterschiede von intrazellulären Interaktionspartnern oder Veränderungen von Signaltransduktionskaskaden, die zu einer Abweichung des epithelialen Programms führen.
Um diesen Möglichkeiten auf den Grund zu gehen, werden entsprechend des Ncadherin-knock-in-Allels weitere Gensubstitutionen vorgenommen. Dabei entstehen synthetische Cadherin-Gene, die ein Molekül exprimieren, das aus dem extrazellulären Teil von E-Cadherin und dem intrazellulären Teil von N-Cadherin besteht (und umgekehrt). Diese sollen dabei helfen aufzudecken, welcher Teil des E-Cadherinmoleküls für die korrekte Bildung des Torphektoderms entscheidend ist (Abb. 3).
Transkriptionelle Regulation der Ecadherin-Expression
Um die Aufgabe im Säugetierembryo wahrzunehmen und damit der Wechsel von einem zum anderen Mitglied der Superfamilie korrekt abläuft, müssen die Cadherine und ihre Expression streng kontrolliert werden. Da eine Fehlexpression zur Tumorentwicklung beiträgt und Metastasen begünstigt, ist eine Kontrolle auch in differenzierten Geweben im adulten Organismus unerlässlich. Es gilt insbesondere, eine Abschaltung des Ecadherin-Gens zu verhindern. In der Arbeitsgruppe um Marc Stemmler wird daher die transkriptionelle Regulation von Ecadherin untersucht. Dabei steht im Vordergrund, welche cis-regulatorischen Elemente und Transkriptionsfaktoren den Locus aktivieren und seine Expression aufrechterhalten.
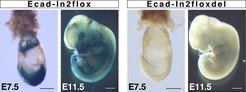
Neben den 16 Exons ist das für die klassischen Cadherine charakteristische große Intron 2 auffällig, das im Fall von Ecadherin 50% des Locus umfasst. Interessanterweise finden sich in diesem Intron eine Vielzahl von DNaseI-hypersensitiven Stellen (DHS), die Hinweise auf die Anwesenheit von cis-regulatorischen Elementen geben. Hingegen ist in der Promoterregion nur eine einzige DHS am Transkriptionsstart vorhanden. Darüber hinaus wurden hauptsächlich Repressoren identifiziert, die alle an eine spezielle DNA-Sequenz (E-box) am Promoter binden und das Gen während der Gastrulation oder in malignen Tumoren abschalten. Um Aufschluss über die biologische Bedeutung der vermuteten cis-regulatorischen Elemente zu erhalten, können experimentell Fragmente des Promoters mit Sequenzen aus Intron 2, die DHS beinhalten, isoliert und kombiniert werden [5]. Die Aktivität eines Reportergens (lacZ), das hinzugefügt wird, kann in einem zeitlichen und räumlichen Rahmen während der Embryonalentwicklung in transgenen Mäusen untersucht werden (transgene Mäuse werden durch zufällige Integration heterologer DNA-Sequenzen ins Genom erhalten). Diese Analysen konnten eindeutig zeigen, dass der Promoter alleine unzureichend ist, um eine Ecadherin-spezifische Expression zu gewährleisten. Hingegen ist für die Aktivierung des Locus im korrekten räumlichen und zeitlichen Fenster die Anwesenheit der Intron 2-DNA-Sequenzen unbedingt erforderlich [5]. Bestätigt wurden diese Ergebnisse durch Manipulationen direkt am Ecadherin-Gen (gerichtete Integration). Wird das gesamte Intron 2 aus dem Locus herausgeschnitten, kann keine Expression eines Reportergens während der frühen Embryonalentwicklung (E7.5) mehr nachgewiesen werden und ist in späteren Stadien, ab E11.5, nur auf sehr niedrigem Niveau vorhanden [6]. Diese Ergebnisse unterstreichen die Bedeutung der cis-regulatorischen Elemente in Intron 2 für die Aktivierung aber auch für die Aufrechterhaltung der Ecadherin-Expression (Abb. 4).
Ausblick
Die klassischen Cadherine spielen während der Embryonalentwicklung und Organogenese eine entscheidende Rolle. Der Wechsel der Expression zwischen E- und N-Cadherin korreliert häufig mit einschneidenden morphogenetischen Ereignissen. Dieser so genannte cadherin switch führt dazu, dass sich die Morphologie der Zellen und ihre Eigenschaften verändern. Dieser epithelial-mesenchymale Übergang wird während der Embryonalentwicklung (Gastrulation), aber erstaunlicherweise auch bei der Tumorentwicklung beobachtet. Welche unterschiedlichen molekularen Funktionen besitzen E- und N-Cadherin, durch die diese drastische Veränderung der Zellmorphologie und der Wechsel der Zelleigenschaften zu erklären sind? Führt bereits der Wechsel der Cadherinexpression zur vollständigen Aktivierung des epithelial-mesenchymalen Programms? Obwohl die klassischen Cadherine ausgiebig untersucht wurden, fehlt dennoch ein detailliertes Verständnis über die molekulare Basis, die die strukturellen und funktionellen Unterschiede zwischen E- und N-Cadherin in physiologischer und pathologischer Situation erklären könnten. Darüber hinaus ist eine sorgfältige Analyse der Genregulation notwendig, um die Funktion der Cadherine und ihrer Gene während der Embryogenese sowie bei der Entstehung von Krebs aufzudecken und zu verstehen.



