Sesam öffne dich
Wie B-Zellen monovalente Antigene erkennen
Eine neue Studie von Freiburger Wissenschaftlern des Max-Planck-Instituts für Immunbiologie und Epigenetik zeigt, wie monovalente Antigene B-Zellen aktivieren.
Nach einer Infektion oder erfolgreichen Impfung werden große Mengen von Antikörpern von den sogenannten B-Zellen produziert. Diese Antikörper bekämpfen eine akute Infektion und schützen uns im Folgenden auch vor weiteren Infektionen. Bevor es zur Freisetzung von spezifischen Antikörpern kommt, müssen die B-Zellen jedoch zunächst aktiviert werden. Dies geschieht durch die Bindung von B-Zellen an fremde oder immunogene Stoffe, die von Immunologen als Antigene bezeichnet werden. Die B-Zellen tragen auf ihrer Oberfläche einen sogenannten B-Zell-Antigenrezeptor (BCR). Wird eine B-Zelle durch die Bindung eines fremden Antigens an ihren BCR aktiviert, differenziert sie sich im Folgenden zu Antikörper-produzierenden Plasmazellen, so dass die feindlichen Strukturen im Rahmen der Immunantwort bekämpft werden.
Das Labor von Michael Reth am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg untersucht die Struktur und Mechanismen der Signalleitung der über 100.000 B-Zell-Antigenrezeptoren auf der Oberfläche jeder B-Zelle. Im Verlauf dieser Erforschung entwickelte das Team dabei ein neues Modell der B-Zellaktivierung. Bisher war angenommen worden, dass die vielen Rezeptoren auf Oberfläche der B-Zellen zufällig verteilt sind und dass die Bindung von Antigenen zu einer sogenannten Kreuzvernetzung („Cross-Linking“) zweier Rezeptoren somit deren Aktivierung führt.
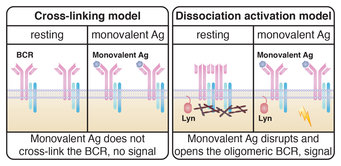
Das Cross-Linking Modell (CLM) kann jedoch nicht die Aktivierung des BCR durch monovalente Antigene erklären. Diese Antigene haben nur eine Bindungsstelle und wären gemäß des Cross-Linking Modells nicht in der Lage, zwei B-Zell-Antigenrezeptoren zu vernetzen und den Signalmechanismus für den Start der Immunantwort auszulösen (Abb. 1). Das „Dissociation-Activation“ Modell (DAM), das 2010 von Jianying Yang und Michael Reth vorgeschlagen wurde, hält hingegen für diesen Fall eine einfache und überzeugende Lösung bereit. „Wir entwickelten eine Methode, um die Organisation von B-Zell-Antigenerezeptoren im Nanometerbereich zu untersuchen. Basierend auf diesen Beobachtungen gehen wir davon aus, dass die Bindung von sowohl mono- als auch polyvalenten Antigenen an die Rezeptoren eine bei unseren Untersuchungen entdeckte und spezifisch strukturierte Anordnung der Rezeptoren stört und somit die Öffnung und Aktivierung hervorgerufen wird”, sagt Michael Reth, der auch Sprecher des Exzellenzcluster BIOSS Centre for Biological Signalling Studies an der Universität Freiburg ist.
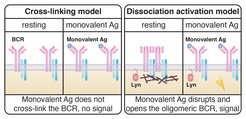
Rechts: Das Dissociation-activation Modell von Yang und Reth (2010) geht davon aus, dass nach der Bindung von monovalenten Antigenen, eine spezifische Anordnung der B-Zellrezeptoren gestört wird und dadurch die Öffnung und Aktivierung erfolgt. Die Studie von Volkmann et al. (2016) kam zudem zu dem Ergebnis, dass die Öffnung des Rezeptors durch monovalente Antikörperfragmente die Anwesenheit und Aktivität des Proteins Lyn benötigt.
Um die jeweilige Plausibilität der beiden vorgeschlagenen Modelle (CLM oder DAM) zu prüfen, ist es entscheidend, die exakten Veränderungen der Organisation der Rezeptoren (Zusammenballung durch Kreuzvernetzung oder Öffnung der Anordnung) nach Bindung von monovalenten Antigenen zu untersuchen. Die aktuelle Studie des Labors von Michael Reth, setzt hierfür auf eine neu entwickelte Mikroskopie-Methode mit verbesserter Auflösung zur Beobachtung. Mittels eines sogenannten Fab-basierten Proximity Ligation Assay (Fab-PLA) konnten zwei Doktoranden des Teams, Christoph Volkmann und Naema Brings, die Veränderung des Abstandes zweier Rezeptoren im 10 bis 20 Nanometer-Bereich nachweisen. Mit diesem Testverfahren studierten sie die Organisation der BCR von B-Zellen aus der Milz von Mäusen. „Als wir die B-Zellen monovalenten Antigen aussetzten, führte diese zum Verlust des IgM:IgM Fab-PLA-Signals. Dieser Befund deutet auf eine Aufspaltung statt auf eine Zusammenballung von Rezeptoren hin und unterstützt entsprechend die Thesen des DAM-Modells“, sagen die beiden Erstautoren der Studie Volkmann und Brings (Abb. 1).
Frühere Experimente in diesem Bereich hatten gezeigt, dass der Rezeptor der B-Zellen, der speziellen anti-Rezeptor-Antikörpern (divalent) ausgesetzt wurde, aktiviert wird, während die Aktivierung durch monovalente Fab-Fragmente fehlschlug. Bei letzteren handelt es sich um monovalente Fragmente eines anti-Rezeptor-Antikörpers. Diese Ergebnisse wurden als Beweis interpretiert, dass nur durch zweiwertige Antikörper oder polyvalente Antigene über die Vernetzung zweier Rezeptoren eine B-Zellaktivierung erfolgt. Die Untersuchungen des Teams von Michael Reth zeigen jedoch, dass ein monovalentes Fab-Fragment durchaus in der Lage ist, den Rezeptor zu öffnen. Jedoch nur dann, wenn es direkt mit der Antigen-Bindungsstelle des Rezeptors interagiert. „Basierend auf unserem Dissociation-Activation-Modell vermuten wir, dass innerhalb der Rezeptorstrukturen die Antigenbindungsstellen eine sehr spezifische Ausrichtung haben. Diese erlaubt es ihnen, sich gegenseitig zu berühren und in der Antigenwahrnehmung zu kooperieren“, sagt Mitautor der Studie Jianying Yang.
Das Team fand auch heraus, dass der Erkennungsvorgang als auch die Öffnung des Rezeptors die Anwesenheit und Aktivität des Proteins Lyn benötigt (Abb. 1). „Wenn den B-Zellen Lyn fehlt, dann sind sie nur noch in der Lage polyvalente Antigene zu erfassen, aber nicht mehr monovalente Antikörperfragmente“, sagt Christoph Volkmann. Diese Ergebnisse zeigen, dass der Rezeptor einen speziellen Mechanismus entwickelt hat, um monovalente Antigene wahrnehmen zu können und ein Signal zur B-Zell-Aktivierung auszusenden.
„Wir sind sehr zufrieden, dass unsere neue Studie das vorgeschlagene BCR-Aktivierungsmodell eindeutig unterstützt“, sagt Michael Reth. Er und sein Team sind davon überzeugt, dass dieser eingeschlagene Weg im Folgenden die Forschung in die Lage versetzt, ein detaillierteres Verständnis der B-Zell-Aktivierung zu erlangen und damit auch neue Strategien zur B-Zell-Aktivierung entwickelt werden können, die Diagnostik und Therapie von Autoimmunerkrankungen oder Krebs bereichern.