Die RNA-Falle
Max-Planck Forscher entdecken, dass eine RNA-Haarnadelstruktur entscheidend für das Überleben männlicher Fruchtfliegen ist
Bei zahlreichen Arten haben die Geschlechter unterschiedliche Chromosomensätze. Beispielsweise besitzen bei Menschen als auch bei der Fruchtfliege Drosophila die Weibchen zwei X-Chromosomen, während die Männchen nur ein X und eine Kopie des viel kleineren Y-Chromosoms besitzen. Gegenüber dem X-Chromosom trägt das Y-Chromosom viel weniger Gene. Die meisten Organismen haben Strategien entwickelt, um diesen Unterschied zwischen den Geschlechtern auszugleichen. Männliche Fruchtfliegen etwa kompensieren diesen Mangel, indem sie die Aktivität ihres einzelnen X-Chromosoms in einem als „Dosiskompensation“ benannten Prozess verdoppeln. Wenn es den männlichen Fliegen nicht gelingt die auf den X-Chromosomen liegenden Gene doppelt so stark auszuprägen, ist dies für die Tiere tödlich.
Eine Reihe spezieller Proteine, der sogenannte MSL-Komplex, sowie nicht-kodierende RNA-Moleküle sind dafür verantwortlich, das der Prozess der Dosiskompensation auf dem männlichen X-Chromosomen gelingt. Das Labor von Asifa Akhtar am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg erforscht die Dosiskompensation. Dazu untersucht das Team die Wechselwirkungen zwischen den beteiligten Proteinen und RNA-Molekülen. In ihrer neuesten Studie konzentrieren sie sich auf das Protein MLE. Dabei handelt es sich um eine sogenannte Helikase, die in der Lage ist, eng umwundenen RNA-Strukturen zu entwinden. Bei Drosophila baut MLE vor allem entscheidende Komponenten der molekularen Dosiskompensationmaschinere um: die nicht-kodierende RNA-Moleküle roX1 und roX2.
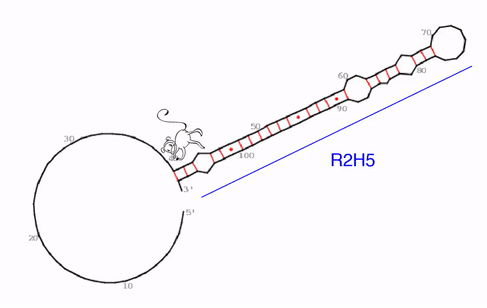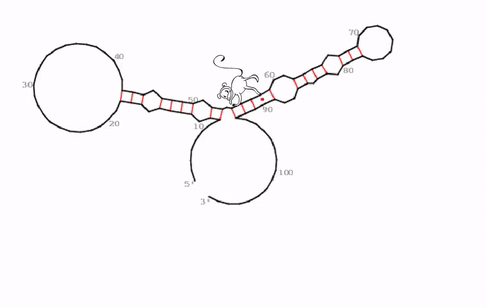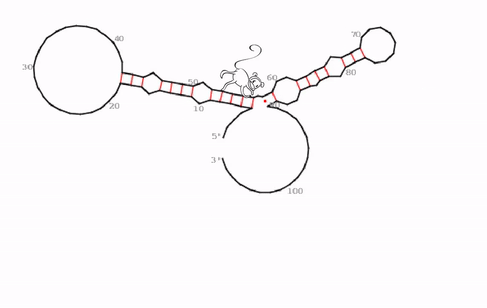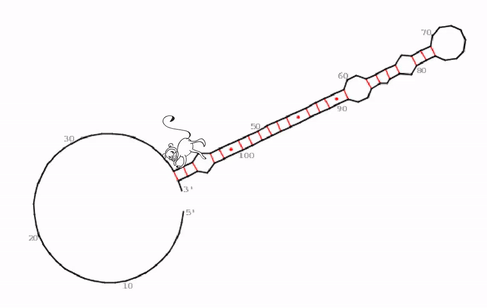
„Wir haben eine sehr spezifische, evolutionär konservierte und auch irgendwie seltsame RNA-Struktur identifiziert können, die der funktionelle Kern von roX2 zu sein scheint,“ sagt Ibrahim Ilik, Erstautor der Studie. Was das Team entdeckte, sind bisher unbekannte „Haarnadelstrukturen“ des RNA-Moleküls. Im Allgemeinen sind Haarnadelstrukturen bei RNA-Molekülen nichts Ungewöhnliches umd kommen häufiger vor. Sie entstehen, wenn einsträngige RNA sich auf sich selbst zurückfaltet und dabei Basenpaarungen mit einem anderen Abschnitt desselben Strangs eingeht. „Was jedoch diese Haarnadelstrukturen bei roX1 so seltsam macht, ist, dass sie eine Art Falle für MLE bildet. Die Helikase scheint in dieser Struktur gefangen zu sein. Wenn sie versucht das RNA-Molekül auf der einen Seite zu entwirren, bildet sich gleichzeitig in einem anderen Teil eine neue Haarnadelstruktur,“ erläutert Ibrahim Ilik.
„Wir vermuten, dass die Funktion der Falle nicht nur darin besteht, MLE einzusperren und auf der RNA zu halten, sondern auch darin ein kleines Stück RNA vorübergehend freizulegen, damit es mit anderen Proteinen interagieren kann,“ erklärt Asifa Akhtar. Wenn MLE auf dem RNA-Moleküle hin und her geht, öffnet und schließt es eine entscheidende Proteinbindungsstelle auf der roX2-RNA. Dadurch werden reversible Wechselwirkungen mit den MSL-Proteinen ermöglicht, die zur Dosiskompensation des X-Chromosoms führen. Die Daten der Freiburger Forscher legen nahe, dass diese Fähigkeit zum kontinuierlichen Öffnen und Schließen der Bindungsstelle entscheidend ist für das Überleben der männlichen Fliegen.
