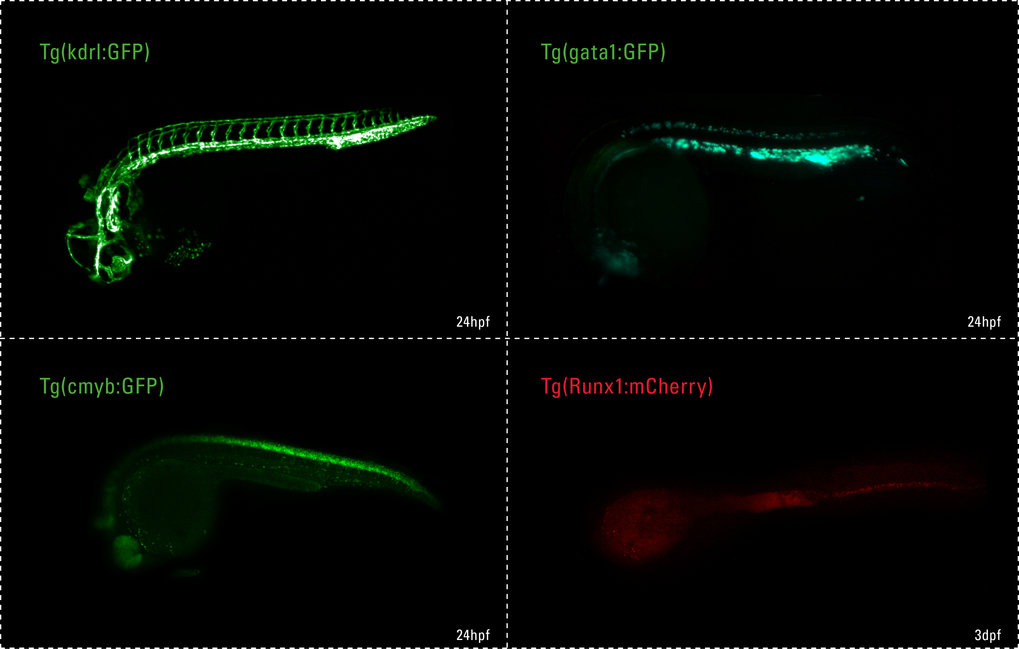
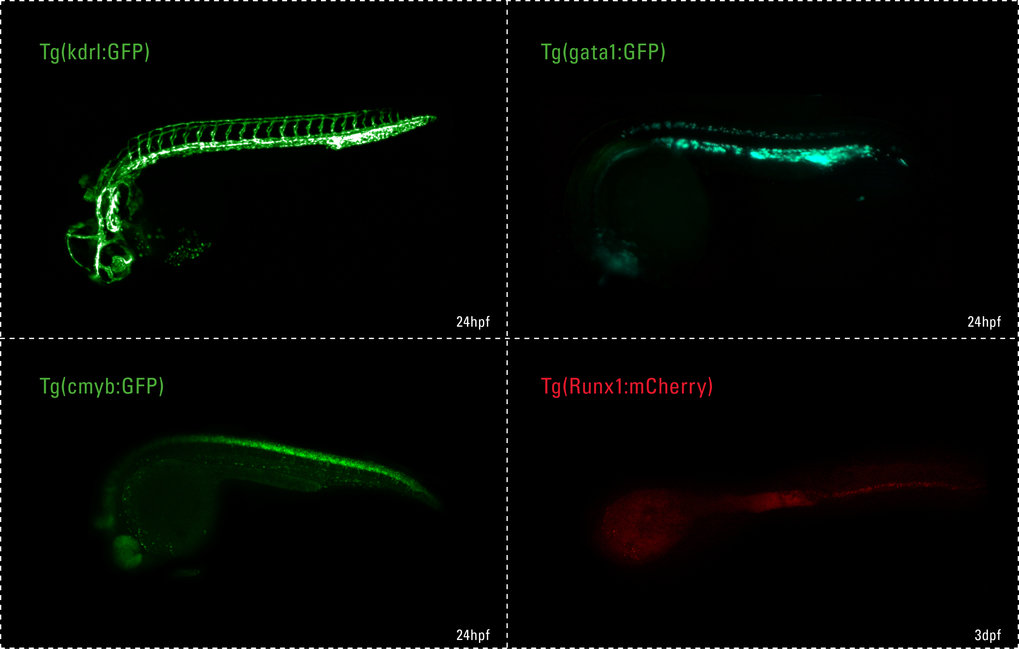
Signalfeuer der Blutbildung
Forschungsbericht (importiert) 2018 - Max-Planck-Institut für Immunbiologie und Epigenetik
Einführung
Hämatopoetische Stammzellen (HSZ), auch als Blutstammzellen bezeichnet, sind in der Lage, alle Blutzellen in unserem Körper zu bilden. HSZ entstehen bereits vor der Geburt während der Embryonalentwicklung und bauen das komplette Blutsystem auf. Im Erwachsenenalter hingegen verhalten sie sich zumeist ruhig. Besteht kein Bedarf an Nachschub, so verharren sie, tief im Knochenmark verborgen, in einer Ruhephase und schützen so ihre wertvollen Funktionen [1, 2].
Die Bildung während der Embryonalentwicklung sowie die Erhaltung und Aktivierung im Erwachsenenalter werden durch verschiedene Signalwege gesteuert. Jedes Ungleichgewicht dieser Prozesse kann das blutbildende System aber sofort stören und zu hämatologischen Krankheiten führen, nicht bösartigen, aber gefährlichen wie beispielsweise schwere Formen der Anämie aber auch bösartigen wie etwa verschiedene Arten der Leukämie.
Diese Krankheiten können mit Blutstammzelltransplantationen behandelt werden. Dabei erhält der Patient Zellen, die einem gesunden Spender entnommen wurden. Jedoch birgt diese Behandlung Risiken, beispielsweise durch mangelnde Kompatibilität zwischen Spender und Empfänger. Deshalb hoffen Forschung und Medizin, diese Stammzellen zukünftig unabhängig vom Organismus (in vitro) zu erzeugen und sie auch außerhalb eines Organismus (ex vivo) zu kultivieren. Dazu müssen wir jedoch zunächst ihre Entstehung und Erhaltung besser verstehen. Unsere Forschung konzentriert sich darauf, die entscheidenden Faktoren und Signalwege zu studieren, die diese Prozesse steuern.
Wandernde Stammzellen im Embryo
Für unsere Forschung verwenden wir Zebrafische als Modellorganismen. Die Tiere haben stets eine große Anzahl an Nachkommen, die sich schnell entwickeln und zudem transparent sind, sodass wir das Wachstum der Organe und die Entwicklung der Zellen beobachten können (Abb. 1).
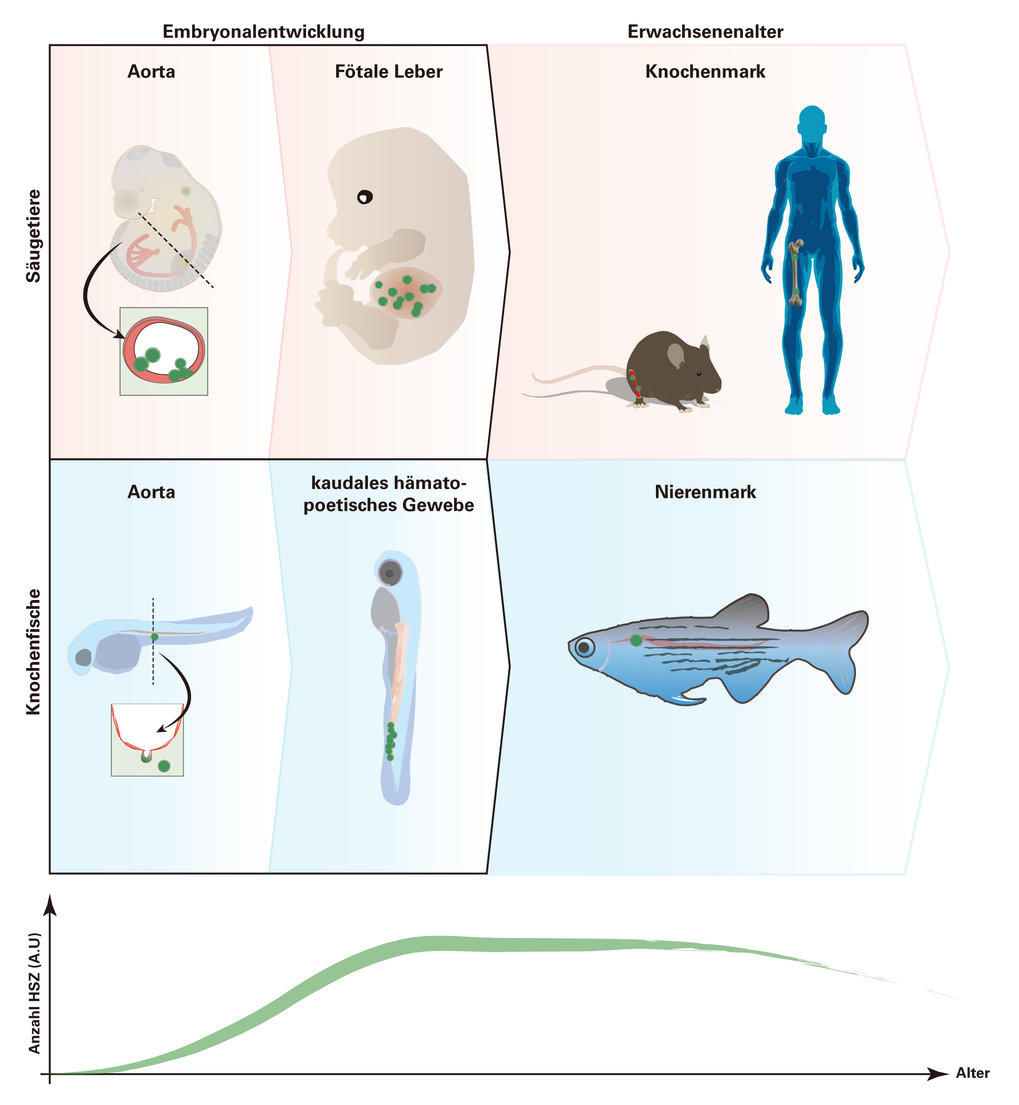
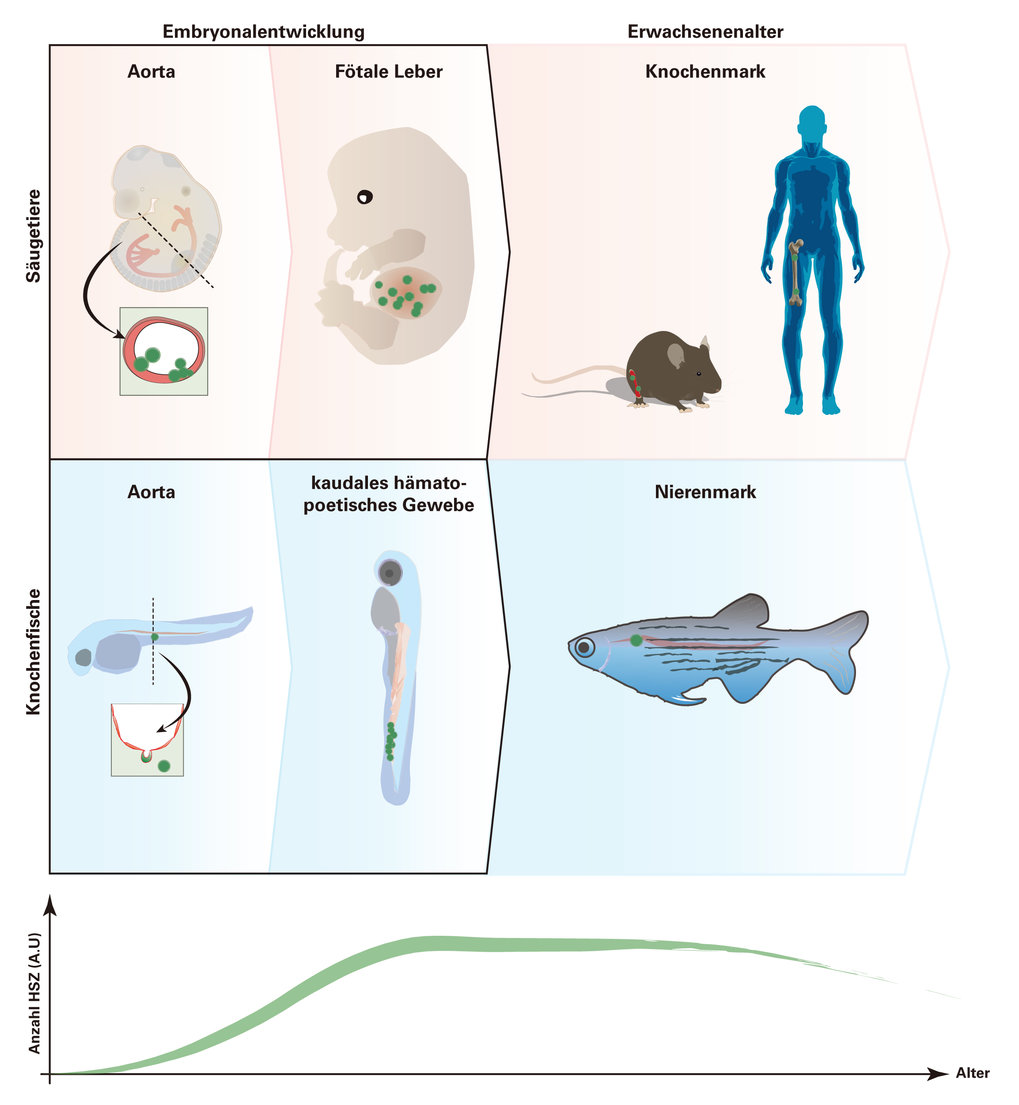
Bei Zebrafischen entstehen die HSZ genau wie bei Säugetieren in der Aorta-Gonaden-Mesonephros-Region (AGM). Anschließend wandern die Zellen bei Fischen zum kaudalen hämatopoetischen Gewebe und bei Säugetieren zur fötalen Leber. Schließlich bilden sie die sogenannten primären lymphatischen Organe: Thymus und Nierenmark bei Fischen beziehungsweise Thymus und Knochenmark bei Säugetieren (Abb. 2). Die Steuerung dieser Entwicklungsprozesse wird seit Jahren intensiv erforscht und zahlreiche Signalwege wurden als wichtige Regulatoren identifiziert. Trotz dieser Erfolge haben wir bis heute kein vollständiges Bild davon, welche Signalnetzwerke die Entstehung und Ausbreitung von HSZ regulieren.
In unserem Labor konzentrieren wir uns auf die Rolle von Entzündungssignalen bei der Blutzellbildung. Lange Zeit ging man davon aus, dass nur adulte HSZ auf diese Signale reagieren, wenn sie etwa im Rahmen eines Blutverlusts oder einer Infektion aktiviert werden. Erst seit kurzem ist aber bekannt, dass Entzündungssignale bereits bei der Bildung der HSZ selbst eine wichtige Rolle spielen [3]. Während der Embryonalentwicklung muss nämlich eine aktive Entzündung auf niedrigem Niveau vorliegen, um die Bildung von HSZ zu gewährleisten. Gleichzeitig müssen aber auch Mechanismen aktiv sein, die die Entzündung auf niedrigem Niveau halten, da zu hohe Entzündungswerte für die HSZ und den Embryo selbst schädlich sind. Unser Ziel ist es festzustellen, welche Entzündungsfaktoren und Mechanismen während der Bildung der HSZ aktiv sind und deren Entstehung regulieren. Zudem wollen wir wissen, was deren Aktivierung im Embryo in einer ja doch typischerweise sauberen und gesunden Umgebung überhaupt auslöst.
Schlafende Stammzellen im erwachsenen Organismus
Eine ständige Aktivität der HSZ würde diese schädigen und letztendlich zu ihrer Erschöpfung führen. Deshalb verharren sie bei erwachsenen Organismen in einem Ruhezustand, der sie vor möglichen Schäden schützt. Erst bei Infektionen oder schwerem Blutverlust durch eine Verletzung beginnen sie wieder, sich verstärkt zu teilen, um neue Blutzellen zu erzeugen. Dass Entzündungssignale HSZ aktivieren können, ist schon seit langem bekannt, jedoch wurde dies stets nur als eine indirekte Folge des Blutzellverlustes angesehen. Erst kürzlich wurde nachgewiesen, dass diese Signale auch von den HSZ selbst wahrgenommen werden und die Reaktivierung auslösen.
Um diese Vorgänge zu verstehen, wollen wir in unserem Labor im Mausmodell Bedingungen in erwachsenen Organismen hervorrufen, die HSZ zur Regeneration anregen. So könnte es gelingen, die relevanten Rezeptoren der Zellen zu identifizieren. Konkret wollen wir erforschen, unter welchen regenerativen Bedingungen die Rezeptoren aktiviert werden und wie das bei der Aktivierung der Rezeptoren ausgelöste Entzündungssignal die „Transkriptionslandschaft“ der HSZ verändert. So können wir nachvollziehen, was im Inneren der Zelle passiert. Diese Signale, so ist anzunehmen, führen letztendlich zur Aktivierung sogenannter Transkriptionsfaktoren, also spezieller Proteine, die an die DNA binden und die Genexpression regulieren, wodurch die Funktionen der Zelle gesteuert werden. Dadurch erhoffen wir zu verstehen, wie diese Signale darüber entscheiden, ob eine Zelle im Ruhezustand verbleibt oder aktiviert wird und beginnt, Blutzellen zu bilden.
Kranke Stammzellen bei Fehlregulierung
Jede Fehlsteuerung von Transkriptionsfaktoren, die an der Regulation der HSZ beteiligt sind, kann die Zellen bösartig verändern und zu Krankheiten wie Leukämie führen. Deshalb konzentrieren sich unsere Experimente auch auf die Untersuchung der Rolle blutbildender Transkriptionsfaktoren bei Krankheiten. Dabei gelang uns vor kurzem, die Funktionsweise des Transkriptionsfaktors HLX aufzuklären, der bei der Mehrzahl von Patienten mit akuter myeloischer Leukämie (AML) überaktiviert ist. Wir konnten zeigen, dass HLX während der Entwicklung einer Blutstammzelle zum sogenannten Myeloblasten, einer Vorläuferzelle von Blutzellen, entscheidende Stoffwechsel-Gene reguliert und der Zelle hilft, ihre eigene metabolische Identität zu erlangen. Die Fehlregulierung von HLX und somit des Stoffwechsels findet sich auch in den Krebszellen von AML-Patienten. Mit den Ergebnissen unserer Studie waren wir zudem in der Lage, einen möglicherweise Erfolg versprechenden Weg zur Behandlung aufzuzeigen. Da die Fehlregulierung von HLX und des Zellstoffwechsels medikamentös eingedämmt werden kann, gelang es uns, die Überlebensrate der Krebszellen deutlich zu reduzieren [4]. Wir sind sehr optimistisch, weitere Transkriptionsfaktoren und deren molekulare Signalwege zu identifizieren, besonders, um schwere Erkrankungen wie die Leukämie in den Griff zu bekommen.