Kartierung von RNA-Signaturen in Nervenzellen
Max Planck Neuro-Entwicklungsgenetiker erfassen fein-orchestrierte Eiweißaktivität der frühen Gehirnentwicklung
Die ELAV/Hu-Proteinfamilie ist eine der wichtigsten Eiweißgruppen in Nervenzellen. Jedes Neuron eines jeden Tieres exprimiert mindestens ein Eiweiß dieser Familie. Geschieht dies nicht, kann sich das Nervensystem nicht entwickeln und die Tiere sterben bereits im Embryonalstadium. Das Labor von Valérie Hilgers am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg hat die Schlüsselmoleküle und den Mechanismus hinter der Funktion von ELAV bei der Gehirnentwicklung erforscht. Mithilfe von Fruchtfliegenmutanten, erzeugt mit der Genschere CRISPR/Cas9, gelang es ihnen, eine genetische Karte zu zeichnen, die die ELAV/Hu-Aktivität in verschiedenen Stadien der Neurogenese mit wichtigen Zielgenen und den physiologischen Effekten für die Fliegen verbindet.
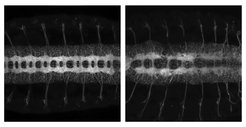
Während der Embryonalentwicklung durchläuft jede einzelne Nervenzelle drastische Veränderungen bezüglich ihrer Form und Funktion. Diese Verwandlung hin zu dem ikonischen Zellkörper mit Axonen und Dendriten ermöglicht es den Zellen voll funktionsfähig zu werden und Verbindungen mit anderen Nervenzellen herzustellen. Eine genau geregelte Aktivität verschiedener Moleküle in den Zellen ist für einen erfolgreichen Umwandlungsprozess notwendig und die Bedingung für eine einwandfreie neuronale Entwicklung und letztlich für die Funktion des Gehirns. Das Labor von Valérie Hilgers am MPI für Immunbiologie und Epigenetik erforscht die molekularen Mechanismen, die diese Prozesse steuern.
Just-in-time Produktion von ELAV
„Wir wussten bereits, dass ein Eiweißmolekül namens ELAV für die neuronale Entwicklung in fast allen Tierarten – vom einfachsten Organismus bis zum Menschen – entscheidend ist. Unsere früheren Studien haben gezeigt, dass dies darauf zurückzuführen ist, dass ELAV die Bildung von Neuronen-spezifischen RNA-Signaturen ermöglicht. Ohne das Protein verlieren Neuronen ihre zelluläre Identität und ähneln molekular gesehen nicht-neuronalen Zellen. Wie und wann ELAV jedoch wirkt oder wirken sollte, ist immer noch ein offenes Rätsel“, sagt Judit Carrasco, die Erstautorin der Studie aus Freiburg.
Das Team untersuchte die neuronale Entwicklung in der Fruchtfliege Drosophila melanogaster. Dazu erzeugten sie Fliegenmutanten mithilfe der Genschere CRISPR, um die ELAV-Expression in verschiedenen Entwicklungsstadien immer wieder an- und abzuschalten. „Wir fanden heraus, dass es zu Beginn der neuronalen Differenzierung ein kurzes Zeitfenster gibt, in dem ELAV absolut lebenswichtig ist. Wenn das Protein zu diesem Zeitpunkt nicht aktiv ist, können die Fliegen nicht überleben. Später brauchen die Neuronen ELAV, um richtig zu funktionieren. So führte eine Verringerung der exprimierten Eiweißmengen zu Fliegen mit schweren neurologischen Schäden“, sagt die Leiterin der Max-Planck-Forschungsgruppe, Valérie Hilgers.
ELAV-Funktion besonders zu Beginn der neuronalen Differenzierung wichtig
Die Bedeutung der präzisen zeitlichen Regulierung der ELAV-Aktivität und ihrer Folgen im Verlauf der neuronalen Entwicklung ist darauf zurückzuführen, dass ELAV ein Hauptregulator der RNA-Biologie in Neuronen ist. „Boten-RNAs (mRNA) sind bekanntermaßen die Zwischenstufen der Genexpression zwischen DNA und Protein. Interessanterweise können die meisten Gene mehrere Varianten, sogenannte Isoformen, von Boten-RNAs produzieren“, erklärt Judit Carrasco. Die Produktion dieser alternativen RNA-Isoformen wird durch das ELAV-Protein bewirkt und spielt eine zentrale Rolle bei der notwendigen Diversifizierung des zellulären Transkriptoms, wodurch jeder Zelltyp eine einzigartige molekulare Signatur erhält.
Durch Tiefensequenzierung konnten die Forscher:innen zeigen, wie bedeutsam die Aktivität von ELAV zu Beginn der neuronalen Differenzierung ist. Im Gegensatz zu den Hunderten von RNA-Isoformen, die in späteren Entwicklungsstadien betroffen sind, hat der Verlust von nur ein paar Dutzend RNAs zu Beginn der Differenzierung schwerwiegende und irreparable Folgen für das Leben der Fliegen. Interessanterweise sind überwiegend Zielgene in ihren regulatorischen Regionen betroffen. Es ist also nicht der Teil der Gensequenz betroffen, der konkret für das Protein kodiert, sondern Bereiche, die die Expression der eigentlichen proteinkodierenden Sequenz des Gens kontrollieren. Die Freiburger Forschungsgruppe vermutet, dass dieser Umstand neue Möglichkeiten eröffnet, die Rolle der posttranskriptionellen Regulierung von RNAs bei der neuronalen Differenzierung zu untersuchen.
Ein Notfallmechanismus gleicht Schwankungen des ELAV-Spiegels aus
Im Menschen, aber auch bei anderen Organismen, wurden Defekte bei ELAV-Eiweißen mit zahlreichen neurologischen Erkrankungen in Verbindung gebracht. Es ist also nicht überraschend, dass komplexe Organismen Reservemechanismen entwickelt haben, um kritische zelluläre Prozesse zu schützen, die durch das ELAV-Eiweiß reguliert werden. In früheren Arbeiten entdeckte das Labor von Valérie Hilgers bereits den EXon-Activated Rescue (EXAR)-Mechanismus, der einspringt, wenn ELAV nicht vorhanden ist. Dann verändert FNE, ein Gen der gleichen Familie, zunehmend seine Position in der Zelle und wandert in den Zellkern, um dort die Funktionen von ELAV zu übernehmen.
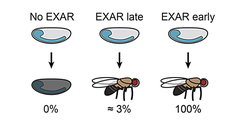
In dieser Studie untersuchte das Team die Bedingungen, unter denen EXAR ein Lebensretter oder vorteilhaft für die Fitness der Tiere sein könnte, wenn das Eiweiß während der frühen embryonalen Entwicklung versagt. „Wir fanden heraus, dass EXAR ein wirklich sehr effektiver Schutzmechanismus ist, der selbst extreme Schwankungen des ELAV-Spiegels kompensiert – bis zu 95 % Verlust“, sagt Valérie Hilgers. Schon kleinste ELAV-Aktivität zu Beginn der neuronalen Zelldifferenzierung reicht aus, um Entwicklungsdefekte zu kompensieren, und später kann der EXAR-Mechanismus alle ELAV-Funktionen vollständig retten. Das Team hat eine Fliegenmutante mit einer sehr frühen und hohen EXAR-Aktivierung entwickelt und konnte zeigen, dass unter diesen Bedingungen alle ELAV-Funktionen wiederhergestellt werden können, sogar im kritischen Entwicklungsfenster. „Hinsichtlich der neuronalen Funktion und der allgemeinen körperlichen Fitness sind diese Fliegen vom Wildtyp mit korrekten ELAV-Werten nicht zu unterscheiden“, erläutert Valérie Hilgers.
Diese Studie wirft ein Licht auf die funktionellen Folgen des Verlusts der ELAV-Funktion an verschiedenen Punkten der Entwicklung. Sie charakterisiert zudem einen zellinternen Rettungsmechanismus zur Wahrung der so wichtigen Zelltyp-Identität durch die Interaktion verschiedener Mitglieder der ELAV-Proteinfamilie. In Zukunft will das Hilgers-Labor untersuchen, wie Defekte in der ELAV-Expression als Reaktion auf Alterung und andere Umweltsignale auch eine Rolle bei der Neurodegeneration spielen.
JC/VH/MR













