Embryonale Musterbildung durch BMP-Signalgradienten
Forschungsbericht (importiert) 2003 - Max-Planck-Institut für Immunbiologie und Epigenetik
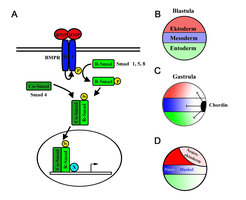
Die "Bone morphogenetic proteins" (BMPs) gehören zur TGF-ß-Familie sezernierter Signalmoleküle. Sie sind an der Regulation einer Vielzahl zellulärer Prozesse beteiligt, wie Zelldifferenzierung, Zelladhäsion, Zellwanderung und programmierter Zelltod. In der Embryonalentwicklung von Wirbeltieren und auch wirbellosen Tierarten kontrollieren BMPs fundamentale Prozesse in der frühen embryonalen Musterbildung und Organogenese. Insbesondere für die Determinierung der dorsoventralen (Rücken-Bauch) Körperachse sind diese Proteine von zentraler Bedeutung. Genetische Studien in der Fruchtfliege Drosophila und beim Zebrafisch, sowie eine Vielzahl funktioneller und biochemischer Studien im südafrikanischen Krallenfrosch Xenopus laevis, haben gezeigt, dass BMPs für die Ausbildung ventraler, mesodermaler (Blut, Nieren) und ektodermaler (Haut) Strukturen notwendig sind und gleichzeitig die Ausbildung dorsaler, mesodermaler (Chorda, Muskelgewebe) und ektodermaler (zentrales Nervensystem) Strukturen hemmen. Xenopus laevis wird seit über 50 Jahren für die Charakterisierung von Musterbildungsprozessen und die funktionelle Analyse von Proteinen genutzt. Die Bedeutung von Xenopus für die moderne Embryologie manifestiert sich unter anderem in der Vielzahl an Genen, die in Xenopus identifiziert und charakterisiert wurden, einschließlich des sezernierten BMP-Antagonisten Chordin. Chordin bindet direkt an BMPs und hemmt deren Interaktion mit BMP-Rezeptoren. Chordin wird spezifisch in der dorsalen Urmundlippe, besser bekannt als Spemann-Organisator, exprimiert. Die lokale Sezernierung von BMP-Inhibitoren vom Spemann-Organisator etabliert im Embryo einen BMP-Aktivitätsgradienten, der die Determinierung embryonaler Territorien entlang der zukünftigen dorsoventralen Köperachse im Ektoderm wie auch im Mesoderm ermöglicht (Abb. 1).
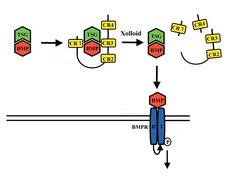
Die Bindung von Chordin an BMP wird durch Zink-Metalloproteinasen der Xolloid-Familie und "Twisted gastrulation" (TSG) reguliert. Das sezernierte TSG-Protein bindet an Chordin und BMP und bildet einen stabilen, inhibitorischen BMP-Tsg-Chordin- Komplex. Metalloproteinasen der Xolloid-Familie spalten Chordin und setzen dadurch aktives BMP frei (Abb. 2). Ähnliche Proteine mit vergleichbaren Funktionen wurden in verschiedenen Vertebraten, aber auch für Drosophila melanogaster beschrieben. Die Konservierung eines derart komplexen Systems interagierender Proteine in verschiedenen Tierstämmen unterstreicht dessen besondere Bedeutung für die Regulation embryonaler Musterbildungsprozesse.
Im vergangenen Jahr haben die Wissenschaftler am MPI für Immunbiologie eine Reihe von Genen identifiziert, deren Expression durch das BMP-Tsg-Chordin-System reguliert wird. Dafür hat die Arbeitsgruppe von Michael Oelgeschläger ein mutiertes Tsg-Protein eingesetzt, das die Bildung des BMP-Tsg-Chordin-Komplexes hemmt. Überexpression dieser Tsg-Mutante im Xenopus-Embryo verhindert die Regulation von BMP-Aktivität durch Chordin und hemmt die Ausbildung des Zentralen Nervensystems und dorsaler, mesodermaler Strukturen. Ein Xenopus laevis-Weibchen legt nach Stimulation mit humanem Gonadotropin mehrere tausend Eier, die sich innerhalb von 1 bis 2 Tagen zu schwimmenden Kaulquappen entwickeln. Die Eier sind relativ groß (1-1.5 mm im Durchmesser) und erlauben eine Vielzahl experimenteller Manipulationen, die in anderen Wirbeltierembryonen kaum durchführbar sind. Xenopus-Embryonen sind daher besonders für differenzielle Screens geeignet. Die Tsg-Mutante wurde durch mRNA-Mikroinjektion in Xenopus- Embryonen überexprimiert, RNA aus Gastrula-Embryonen isoliert und mithilfe von Microarrays und Library-Filter mit der RNA aus Kontrollembryonen verglichen. Für eine Reihe von Genen konnten die Forscher einen signifikanten Effekt der Tsg-Mutante auf deren Expression im frühen Xenopus-Embryo nachweisen und die transkriptionelle Regulation und Aktivität dieser Gene in der Embryonalentwicklung von Xenopus wurde weitergehend untersucht.
Eines der ersten Gene, das in diesen Screens identifiziert wurde, gehört zur Tetraspanin-Familie, die in Wirbeltieren über 20 verschiedene Proteine umfasst. Diese sind durch vier Transmembran-Domänen und eine große, extrazelluläre Schleifen-Domäne, die Tetraspanin-spezifische Aminosäurenmotive beinhaltet, charakterisiert (Abb. 3). Die große, extrazelluläre Domäne ist notwendig für die Interaktion von Tetraspanins mit einer Vielzahl an Membranproteinen, vor allem Proteinen der Integrin-Familie, die zelluläre Interaktionen mit der extrazellulären Matrix vermitteln. Für verschiedene Tetraspanins wurde eine wichtige Funktion in der Steuerung von Zellbeweglichkeit und Zelladhäsion nachgewiesen und das Expressionsmuster von Xenopus-Tetraspanin (xTspan) weist ebenfalls auf eine Funktion in der Regulation von gerichteten Zellbewegungen hin. Xenopus-Tspan ist spezifisch in Bereichen des Gastrulaembryos exprimiert, wo Zellen in das Blastocoel einwandern und im Neurula-Stadium in der sich schließenden Neuralplatte. In späteren Larvalstadien ist xTspan-mRNA in der Zement- und Schlüpf-Drüse im Kopfbereich und im posterioren Neuralrohr nachweisbar. Dieses dynamische Expressionmuster korreliert vor allem in den frühen Entwicklungsstadien mit embryonalen Territorien, die ausgeprägte, gerichtete Zellbewegungen durchführen.
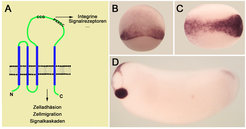
Durch ektopische Expression von xTspan und spezifischer Hemmung der Translation von endogenem xTspan mithilfe von Morpholino-Oligomeren, konnten die Wissenschaftler in Freiburg nachweisen, dass xTspan gerichtete Zellbewegungen im frühen Xenopus-Embryo steuert. Dabei scheint xTspan jedoch die Determinierung die verschiedenen Zelltypen entlang der dorsoventralen Achse nicht zu beeinflussen. Die molekularen Mechanismen, durch die xTspan seine Funktion im frühen Embryo ausübt, werden zurzeit analysiert. Die Regulation der xTspan-Expression durch das BMP-Tsg-Chordin-System und seine Funktion in der Morphogenese des frühen Xenopus-Embryos impliziert eine weitere Funktion des BMP- Signalgradienten. Neben seiner essentiellen Funktion für die Determinierung embryonaler Territorien entlang der dorsoventralen Körperachse weisen immer mehr Studien auf eine wichtige Funktion des BMP-Signalgradienten in der Steuerung von Zellbewegungen hin. Xenopus-Tspan scheint zu der Gruppe von BMP-regulierten Genen zu gehören, die diese Funktion des BMP-Signalgradienten vermitteln. Die Charakterisierung von Genen, die spezifisch die verschiedenen Funktionen des BMP-Aktivitätsgradienten in der frühen Embryonalentwicklung vermitteln, wird zu einem tieferen Verständnis von der Koordination von Zellbewegungen und Zelldifferenzierung in der frühen Embryonalentwicklung beitragen.


