Den molekularen Lego-Plan verstehen
Neues strukturelles Verständnis vom Histon-modifizierenden Komplex NSL und Wechselspielern zeigt therapeutische Gefahren.
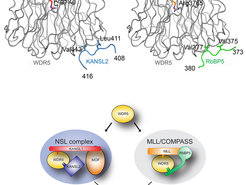
Vergleich des NSL-Komplexes mit dem MLL/COMPASS-Komplex.
Wann Gene abgelesen werden, ist ganz präzise gesteuert. Eine wichtige Ebene dieser Steuerung ist die Veränderung des DNA-Protein-Polymers, der Chromatin genannt wird. Veränderungen des Chromatins führen dazu, dass das Erbgut besser oder schlechter zugänglich ist für die Ablese-Maschinerie der Zelle. Einer dieser Regulatoren in der Fruchtfliege ist der NSL-Komplex. Er steuert mehr als 4000 Gene.
In gemeinsamen Anstrengungen der Forschungsgruppen um Dr. Asifa Akhtar (MPI-IE Freiburg) und Dr. Jan Kadlec/Dr. Stephen Cusack (EMBL Grenoble) konnten die Wissenschaftler erstmals die molekulare Architektur des NSL-Komplexes identifizieren. Zudem beleuchteten sie die Rolle des Proteins WDR5 für die Zusammenstellung und Funktion des NSL-Komplexes. Sie erkannten, dass die NSL-Elemente KANSL1 und KANSL2 mit genau den gleichen Bereichen des WDR5-Moleküls wechselwirken wie die Elemente MLL(s) und RbBP5 im bereits bekannten MLL-Komplex. Fehlsteuerungen dieses MLL-Komplexes führen häufig zu der Leukämie-Erkrankung des 'mixed-lineage-leukemia'-Typs.
Die Erkenntnis, dass beide Komplexe an den gleichen Stellen binden, hat den Blick der Wissenschaftler auf das Protein WDR5 verändert. „Bisher wurde angenommen, dass WDR5 ein Verbindungselement ist zwischen den beiden Chromatin-verändernden Komplexen NSL und MLL. Tatsächlich aber geht das Protein mit den Komplexen sich gegenseitig ausschließende Wechselwirkungen ein, was die Integration oder Trennung der Signale der einzelnen Histon-modifizierenden Komplexe ermöglicht“, sagt Akhtar.
Die Wissenschaftler zeigten auch, dass das Zusammenspiel von WDR5 und KANSL1 (ebenso wie mit MLL) für das Überleben der Fruchtfliege Drosophila sehr wichtig ist. Darum und aufgrund des hohen Konservierungsgrades des NSL-Komplexes zwischen Fliege und Mensch dürfte diese Interaktion auch im Menschen eine zentrale Rolle spielen.
Darüber hinaus weisen die Studienergebnisse auf mögliche Risiken hin bei einem eigentlich vielversprechenden Therapie-Typ von myeloider oder lymphoider Leukämie. Erst kürzlich war ein Therapieansatz vorgeschlagen worden, bei dem mit neu entdeckten Wirkstoffkandidaten auf die Verbindung von WDR5 und MLL(s) abgezielt werden soll. Diese Art des Eingriffs muss nun überdacht werden, da er auch die Wechselwirkung zwischen WDR5 und KANSL1 beeinflussen dürfte und damit auch die Einheit des NSL-Komplexes.
Der NSL-Komplex war 2006 im Labor von Asifa Akhtar entdeckt worden. „Es ist ganz entscheidend zu verstehen, wie diese epigenetischen Steuerungskomplexe ‚wie ein Lego-Puzzle’ aufgebaut sind. Nur dann wird es uns gelingen, wesentliche Fortschritte in der Entwicklung spezifischer Wirkstoffe für epigenetische Therapien zu machen“, erklärt Kadlec. Für ihre Studien verbanden die Wissenschaftler Forschungsansätze von der Strukturbiologie bis hin zu Genetik bei Mensch und Fliege.
