Schicksalhaftes Rauschen der Gene
Max-Planck-Forscher entwickelt Verfahren zur Messung von Genexpressionsrauschen in komplexem Gewebe
Wichtige Gene werden während der Entwicklung von Zellen häufig mit hohem Variabilitätsumfang exprimiert. Die Wissenschaft nennt dieses Phänomen „biologisches Rauschen“ und vermutet, dass es mitentscheidend dafür ist, welchen Entwicklungsweg eine Zelle nimmt. Der Max-Planck-Forscher Dominic Grün stellt nun eine Methode vor basierend auf Einzelzelldaten, mit der es möglich ist, diese Variabilität der Genexpression zu quantifizieren. Der Vorteil der sogenannten VarID-Methode besteht darin, dass das Rauschen der Genexpression über Gruppen von sehr ähnlichen oder verwandten Zellzuständen hinweg gemessen werden kann. Dadurch erhofft der Freiburger Forscher besser zu verstehen, inwieweit das Rauschen die Entwicklung reguliert oder sogar für die Differenzierung der Zellen erforderlich ist.
Zellen sind die Bausteine des Lebens. Um mehr über die unterschiedlichen Zelltypen zu erfahren und einen Einblick in die molekularen Prozesse jeder einzelnen Zelle zu erhalten, nutzen Wissenschaftler die sogenannte Einzelzell-RNA-Sequenzierung. Dabei wird die Anzahl von Boten-RNA-Molekülen (mRNA) gemessen, die durch gerade aktive Gene in den einzelnen Zellen erzeugt werden. Je nach Typ und Entwicklungsstand aktivieren Zellen unterschiedliche Gene, die zunächst in RNA-Moleküle übersetzt werden, welche die Grundlage für die Synthese von Proteinen darstellen.
Die Identität der Zelle
Wie eine Art Fingerabdruck gibt die Anzahl der verschiedenen mRNA-Moleküle je Gen in einer bestimmten Zelle Aufschluss über die Zellidentität sowie über die Verwandschaftsbeziehungen zwischen den Zellen. So konnten in den letzten Jahren sowohl bekannte Zelltypen bestätigt als auch neue Zelltypen und Zellsubtypen identifiziert werden. Die Einzelzellsequenzierung ermöglicht aber auch weitere Einblicke in die Zelle. Mithilfe der Messungen können einzelne Zellen in ihrer räumlichen Anordnung im Gewebe analysiert sowie Entwicklungswege und Übergangszustände zwischen Zellzuständen und -typen identifiziert werden.
„Viele Erkrankungen wie etwa Krebs entstehen dadurch, dass Zellen ihre Entwicklung beginnend von der Stammzelle bis zur Reife nicht vollständig vollziehen und stattdessen in einem Vorläuferstadium verharren und beginnen sich unkontrolliert zu vermehren. Wir wollen verstehen, was in der Zelle passiert, wenn diese Entwicklungsstörung auftritt, und entwickeln dafür spezielle Algorithmen zur Verarbeitung und Analyse der Einzelzelldaten,” sagt Max-Planck-Forschungsgruppenleiter Dominic Grün.
Die Genexpression ist verrauscht
Die Schwierigkeit besteht darin, dass wichtige Gene – wie beispielsweise Transkriptionsfaktoren, die vermitteln, welche Gene ein- oder ausgeschaltet werden sollen – bei der Zelldifferenzierung häufig nur schwach exprimiert werden, teilweise mit hoher Variabilität in Zellen des gleichen Typs. Die Forschung spricht hierbei vom sogenannten „biologischen Rauschen“. Entsprechend sind Expressionsunterschiede solcher Gene in den Daten nur schwer zu erkennen.
„Hinzu kommt, dass gegenwärtig verfügbare Analysemethoden sich fast ausschließlich auf die Genexpression innerhalb einzelner Zellen konzentrieren und die biologische Rolle von Genexpressionsrauschen bei der Zelldifferenzierung und dem Übergang zwischen verschiedenen Zellzuständen noch nicht eingehend untersucht wurde,“ erläutert Grün.
VarID quantifiziert die Variabilität der Genexpression
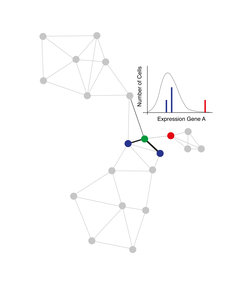
Abb. 2 VarID verknüpft Zellen basierend auf der Ähnlichkeit ihrer Genexpressionsprofile und quantifiziert die Variabilität der Genexpression in lokalen Gruppen ähnlicher Zellen.
Die nun vorgestellte neue VarID-Methode des Freiburger Max-Planck-Labors adressiert diese Lücke, indem sie das Rauschen der Genexpression über Gruppen von sehr ähnlichen oder verwandten Zellzuständen hinweg quantifiziert. Dadurch ist es möglich, beispielsweise die Dynamik von Genexpressionsrauschen im Laufe der Differenzierung von Stammzellen zu reifen Zelltypen zu erforschen und zu untersuchen, inwieweit das Rauschen die Entwicklung reguliert oder sogar für die Differenzierung der Zellen erforderlich ist.
Kernstück der VarID-Methode ist ein von Dominic Grün entwickelter Algorithmus, der aus den gemessenen Einzelzelldaten komplexer Mischungen von Zelltypen die Dynamik der Variabilität der Genexpression quantifiziert. So lassen sich Unterschiede in der Genexpressionsvariabilität zwischen Nachbarschaften beschreiben. Insbesondere ermöglicht dies, die Aktivität von schwachen und in den Daten verrauschten Transkriptionsfaktoren aufzeigen, die am Zustandsübergang der Zellen beteiligt sind.
Genrauschen bestimmt das Zellschicksal
Mithilfe der VarID-Methode ist es so beispielsweise gelungen, die Aktivität wichtiger Transkriptionsfaktoren im Verlauf der Entwicklung von Blutzellen der Maus nachzuvollziehen. „Die Analysen zeigen, dass entscheidende Transkriptionsfaktoren, die in reifen Blutzellen im Mausknochenmark exprimiert werden, in Blutstammzellen nur schwach – dafür aber sehr variabel – exprimiert werden. Wir vermuten, dass die schwankende Aktivität dieser Gennetzwerke, also das Rauschen der Genexpression, zur Initiierung der Differenzierung führen kann,“ sagt Dominic Grün.
Der Max-Planck-Forschungsgruppenleiter Dominic Grün ist sich sicher, dass das Genrauschen ein wichtiger Bestandteil bei den Entscheidungsprozessen der Zelle über ihre Zukunft ist. „Die VarID-Methode öffnet uns die Tür, um die Rolle des Genexpressionsrauschens bei der Stammzelldifferenzierung zu beleuchten. Da wir nun in der Lage sind das Rauschen der Genexpression zu messen, hoffen wir zukünftig besser zu verstehen, wie dieses die Zellschicksale reguliert.“
MR



