Regelkreise von B-Lymphozyten
Labor Grosschedl

Der Prozess der B-Lymphopoese ist von der Integration extrazellulärer Signale durch Transkriptionsfaktoren abhängig. Diese spezifizieren die hämatopoetischen Vorläuferzellen und ermöglichen so die Differenzierung in hochspezialisierte Effektorzellen. Unser Labor untersucht die molekulare Basis dieser B-Zell-Differenzierung, indem wir die regulatorischen Schaltkreise analysieren, in denen diese Zelltyp-spezifischen Transkriptionsfaktoren operieren.
In Hinblick auf dieses Ziel erforschen wir die Funktion des „early B cell factor-1“, EBF1, der in frühen Stadien der B-Zell-Entwicklung und in Stromazellen des Knochenmarks exprimiert wird. ‚Gain-of-function’ und ‚loss-of-function’-Experimente erlaubten uns Einblicke in die Rolle von EBF1 bei der Aktivierung von B-Zelllinien-Genen und bei der Unterdrückung alternativer Zellentwicklungen. Wir konnten ermitteln, dass EBF1 gemeinsam mit anderen Transkriptionsfaktoren in einem regulatorischen Netzwerk wirkt, indem positive Feedback-Schleifen und wechselseitige Hemmungen die Errichtung des B-Zell-Programms stabilisieren.
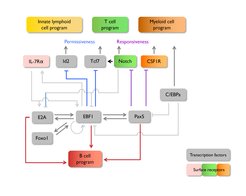
Die genomweiten Analysen von an EBF1 gebundenen Genregionen und von durch EBFI regulierter Genexpression zeigten, dass EBF1 nicht nur entsprechende Gene aktiviert, die die Entwicklung zur B-Zelllinie hervorrufen, sondern auch Gene unterdrückt, die alternative hämatopoetischen Entwicklungslinien fördern würden. Darüber hinaus lässt EBF1 Gene für die Expression in späteren Stadien verharren, indem es die Dimethylierung des Histons H3K4 veranlasst.
Kürzlich konnten wir zudem eine Region in EBF1 identifizieren, die eine Bindung an unzugänglichem Chromatin (naiver Zustand) in Vorläuferzellen ermöglicht. EBF1 kann so das Zellschicksal durch die Begünstigung von Bindungsprozessen anderer Transkriptionsfaktoren sowie dem Rückgang der DNA-Methylierung bestimmen. Darüber hinaus konnten wir zeigen, dass in die Aufrechterhaltung des B-Zell-Schicksals eine Art „doppelter Verriegelungsmechanismus“ involviert ist, indem EBF1 und Pax5 die Expression verschiedener Gene unterdrücken, die die Toleranz und Ansprechbarkeit der Zellen auf alternative Zellschicksale steuern.

