Unerlässlicher Transporter für die T-Zellbiologie
Wie ein Transportprotein die RNA-Reifung in T-Killerzellen sicherstellt
Um eine wirksame Immunabwehr zu unterstützen, sind T-Zellen auf die Expression antigenspezifischer Rezeptoren angewiesen, die potenzielle Krankheitserreger erkennen und die lebensrettende Immunreaktion auslösen. In einer aktuellen Studie haben Wissenschaftlerinnen und Wissenschaftler am Max-Planck-Institut für Immunbiologie und Epigenetik einen neuen Mechanismus entdeckt, der einen der ersten Schritte in der Kaskade der Bildung solcher Antigenrezeptoren sicherstellen. Sie entdeckten ein nukleäres Importprotein, ohne das die Produktion der mRNA-Matrize für eine spezifische Rezeptorkomponente der invarianten natürlichen Killer T (iNKT) Zellen nicht möglich ist. Dadurch wird die typische schnelle Immunantwort von iNKT-Zellen vollständig aufgehoben und eine wichtige Säule der Erstlinien-Immunabwehr eliminiert.
Im Immunsystem der Wirbeltiere stellen herkömmliche Helfer- und Killer-T-Zellen die Fähigkeit zu spezifischen Immunantworten sicher, einschließlich der Bildung eines immunologischen Gedächtnisses. Solche T-Zellen exprimieren ein umfangreiches Repertoire an strukturell unterschiedlichen Antigenrezeptoren, die als T-Zell-Rezeptoren (TCRs) bezeichnet werden; diese werden durch Peptidantigene aktiviert, die den T-Zellen von den polymorphen klassischen MHC-Klasse-I- und Klasse-II-Molekülen präsentiert werden.
Im Gegensatz dazu weisen andere vom Thymus abgeleitete Populationen von T-Zellen, wie zum Beispiel invariante natürliche Killer T-Zellen (iNKT), eine viel eingeschränktere Diversität ihrer Antigenrezeptoren auf; sie erkennen endogene und exogene Glykolipide, die von invarianten, sogenannten nicht-klassischen MHC-ähnlichen Moleküle präsentiert werden. Die iNKT-Zellen sind nicht auf vorherige Exposition mit Antigenen angewiesen, um schnell auf die Erkennung relevanter Antigene reagieren zu können. Sie sind daher unerlässlich, um dem Wirtsorganismus eine rasche Immunantwort zu ermöglichen. iNKT-Zellen exprimieren einen semiinvarianten TCR, der aus einer invarianten TCR-Alpha-Kette besteht, die sich mit einer begrenzten Anzahl von TCR-Beta-Ketten paart, um den zelltypischen heterodimeren ab-TCR zu bilden. Die Entwicklung von iNKT-Zellen folgt einem instruktiven Modus, wobei die Bildung und Expression des semi-invarianten TCR den wesentlichen ersten Schritt der Entstehung diesers Zelltyps darstellt.
mRNA-Matritzenproduktion von T-Zellrezeptoren
Mit einem großangelegten Screening-Experiment untersuchte ein Team um Max-Planck-Direktor Thomas Boehm zentrale Mechanismen, die der Entwicklung dieses T-Zelltyps zugrundeliegen. Die Forscherinnen und Forscher am Max-Planck-Institut für Immunbiologie und Epigenetik entdeckten dabei einen bisher unerkannten Aspekt der TCR-Biologie auf: das kontextspezifische Spleißen von Primärtranskripten der TCR-Alpha-Ketten-Gene.
Primärtranskripte der Gene, sogenannte Prä-mRNAs, sind die ersten Produkte, die beim Umschreiben der DNA zu RNA entstehen. Sie enthalten neben den Abschnitten, die tatsächlich für Proteine kodieren (Exons) noch weitere nicht-proteinkodierende Abschnitte (Introns). Entsprechend müssen Prä-mRNAs einer präzisen Verarbeitung unterzogen werden, dem sogenannten Spleißen, um Intron-Sequenzen herauszuschneiden und reife mRNAs zu erzeugen, deren Information dann in funktionelle Proteine übersetzt werden können.
„Primärtranskripte von Antigenrezeptorgenen bilden da natürlich keine Ausnahme. TCR-Alpha-Gene enthalten mehrere Intron-Sequenzen unterschiedlicher Länge, die während des Reifungsprozesses entfernt werden müssen,“ erklärt Thomas Boehm. Aufgrund der komplexen und häufig gewebespezifischen Natur des Prä-mRNA-Spleißprozesses ist eine große Anzahl zusätzlicher Spleißregulatoren nötig, die mit der zentralen Spleißosomenmaschinerie zusammenarbeiten und sicherstellen, dass Introns korrekt entfernt und die angrenzenden Exons miteinander zur fertigen mRNA verknüpft werden.
Transportprotein kontrolliert den Spleißprozess der Immunzell-Primärtranskripte
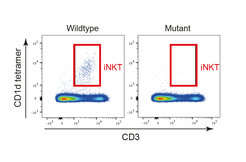
Viele dieser Spleißregulatoren werden durch spezielle Proteintransporter der b-Karyopherin-Familie, wie beispielsweise Transportin 3 (Tnpo3), in den Zellkern verbracht. Dabei entdeckte das Team eine unerwartet spezifische Rolle von Tnpo3 im Prä-mRNA-Spleißprozess der kanonischen TCR-Alpha-Kette von iNKT-Zellen: Fehlt funktionsfähiges Tnpo3, schlägt der Spleißprozess fehl und es entwickeln sich keine iNKT-Zellen. Dieses Ergebnis sei aus zwei Gründen bedeutsam, erklärt Thomas Boehm: „Erstens ist es bemerkenswert, dass die Entwicklung (und nicht die Differenzierung) eines gesamten Typs von T-Zellen von nur einem Faktor innerhalb der komplexen Hierarchie der Spleißfaktoren abhängt. Zweitens ist die Tatsache, dass das Spleißen der TCR-Alpha-Prä-mRNA vom iNKT-Typ so spezifisch reguliert wird und andere nicht betrifft, ein völlig neuer Aspekt der T-Zellbiologie.“
Die Studie im Fachjournal Nature Communications ist ein weiteres Puzzleteil in einem großangelegten Projekt der Abteilung für Entwicklungsimmunologie am MPI in Freiburg. Es zielt darauf ab, die molekularen Grundlagen der T-Zell-Entwicklung zu identifizieren und den evolutionären Verlauf der adaptiven Immunfunktionen bei Wirbeltieren zu rekonstruieren. „Wir wissen jetzt nach dieser Studie in der Maus, dass der Bedarf an Tnpo3 für die T-Zell-Entwicklung evolutionär konserviert ist, da eine Tnpo3-Mutation im Zebrafisch, einem Vertreter von Knochenfischen, die sich seit 300 Millionen Jahren unabhängig von Säugern entwickeln, ebenfalls zu einer Beeinträchtigung der T-Zellentwicklung führt,“ erläutert Projektleiter Norimasa Iwanami, der jetzt an der Universität Utsunomiya in Japan arbeitet.
Die Aufdeckung der Funktionsweisen und Gründe für Funktionsstörung wichtiger Immunzellen in verschiedenen Spezies verspricht nicht nur, unser Verständnis des Immunsystems von Säugetieren zu verbessern, sondern könnte auch eine Inspirationsquelle für neue medizinische Diagnosen oder Therapieansätze sein.
TB/MR












